| Дома вам было дано задание охарактеризовать кремний как ХЭ, давайте проверим, как вы справились с домашним заданием. Кремний – химический элемент. 1) Положение кремния в ПСХЭ. 1. Химический знак – Si 2. Порядковый номер – 14 3. Атомная масса – 28,086 4. Кремний находится в IV группе, гл. подгруппе, 3 малый период. 2) В природе кремний представлен тремя стабильными изотопами: 28Si (92,28%); 29Si (4,68%); 30Si (3,05%) 3) Рассмотрим строение атома:
1. Число протонов, электронов, нейтронов: 14р+; 14ē; 14 ń0. 2. Электронная формула: 1s2 2s2 2p6 3s2 3p2 3. Электронно-графическая формула: 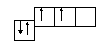
3s 3p 4) Семейство - р-элемент 5) Важнейшие степени окисления: -4; 0; +4. 6) Характер элемента - неметалл 7) Соединения ХЭ 1. Высший оксид - оксид кремния (IV) SiO2 2. Высший гидроксид – кремниевая кислота H2SiO3 3. Летучее водородное соединение – силан SiH4
А теперь мы рассмотрим нахождение кремния в природе. Кремний – это один из распространенных в земле элементов (25% массы). Главная часть находится в соединениях кремния с кислородом и др. металлами – силикатных породах. Соединения, в состав которых входит оксид алюминия, называются алюмосиликатами. Таковы белая глина, слюда, полевой шпат. Значительная часть кремния представлена оксидом кремния (IV) – кремнезема. Окрашивание оксида кремния (IV) различными примесями образует драгоценные и полудрагоценные камни, например, изумруд, топаз, аквамарин и др. Вообще в чистом виде кремний был выделен в 1811 году французским учёным Жозефом Луи Гей–Люссаком и Луи Жаком Тенаром. Название кремний произошло от латинского «silex» - кремень, но в 1834 году русский химик Герман Иванович Гесс ввел другое название – кремний.
Рассмотрим кремний как простое вещество. 1) Химическая формула – Si 2) Молекулярная масса – 28,086 3) Тип хим. связи -ковалентная неполярная 4) Тип структуры кристаллической решётки- атомная Кремний может находиться в 2х аллотропных модификациях: Аллотропные модификации | Аморфный кремний | Кристаллический кремний | | Представляет собой бурый порошок, с температурой плавления 1420 °С. | Твёрдое вещество, темно-серого цвета со слабым металлическим блеском, обладает тепло- и электро- проводимостью. |
Наконец мы добрались до химических свойств. Химические свойства кремния мы рассмотрим по следующей схеме:  Ме Ме   СВ Si ПВ СВ Si ПВ  неМе неМе
Проявляет восстановительные свойства: Реагирует с простыми веществами – неметаллами а) с галогенами: Si +2F2 = SiF4 Si + 2Cl2 = SiCl4 Si + 2Br2 = SiBr4 б) с кислородом (при t°) Si + O2 = SiO2
2. Взаимодействует со сложными веществами а) кислотами: 3Si+12HF+4HNO3 = 3SiF4+4NO+8H2O б) щелочами: Si+2NaOH+H2O = Na2SiO3+2H2
Проявляет окислительные свойства: а) с металлами: Si+2Mg = Mg2Si
Кремний применяется во многих отраслях промышленности: - при производстве жаропрочных и кислотоупорных сталей - электротехнике - солнечных батареях.
Поговорим о получении кремния. Кремний получают как в промышленности, так и лаборатории.
-в промышленности В электрических печах при высокой температуре происходит восстановление кремния из его оксида коксом (углём): SiO2+2C = Si+2CO -в лаборатории В качестве восстановителей используют магний или алюминий: SiO2+2Mg = Si+2MgO 3SiO2+4Al = 3Si+2Al2O3
| 

 Получите свидетельство
Получите свидетельство Вход
Вход


 ремний как ХЭ и ПВ.
ремний как ХЭ и ПВ.

 Ме
Ме
 СВ Si ПВ
СВ Si ПВ неМе
неМе








 Конспект урока по химии "Кремний" (82.5 КB)
Конспект урока по химии "Кремний" (82.5 КB)
 0
0 852
852 61
61 Нравится
0
Нравится
0










