Урок 27
Кремний и его соединение. Силикаты. Полупроводниковые материалы на основе кремния. Силикатная промышленность Казахстана.
Тип урока: изучение и закрепление нового материала
Цель: Познакомить учащихся с кремнием и его соединениями, продолжить закрепление умений и навыков давать характеристику элемента по его положению в ПСХЭ.
Задачи:
сформировать знания учащихся о химическом элементе кремнии, о свойствах образованных им простых и сложных веществ;
воспитывать доброжелательность, коммуникабельность;
воспитание толерантности (уважение мнения других); продолжить воспитание познавательного интереса к предмету.
Ход урока:
1.Орг момент
2 Проверка домашнего задания
Общая характеристика углерода и нахождение его в природе(у)
Физические свойства аллотропных видоизменений углерода(п)
Химические свойства углерода (п)
Характеристика оксида углерода (п)
Характеристика угольной кислоты(п)
Для класса: цепочка превращений стр 135 упр 6
3 Изучение нового материала
Сегодня продолжаем изучать не металлы, и кремний является заключительным уроком по изучению большого раздела неметаллов и их соединений.
Откройте разворот ваших тетрадей и поделите его на 4 колонны и в центре напишите химический символ кремния. Откройте ПТХЭ и охарактеризуйте положение кремния в таблице и составим визитную карточку химического элемента.
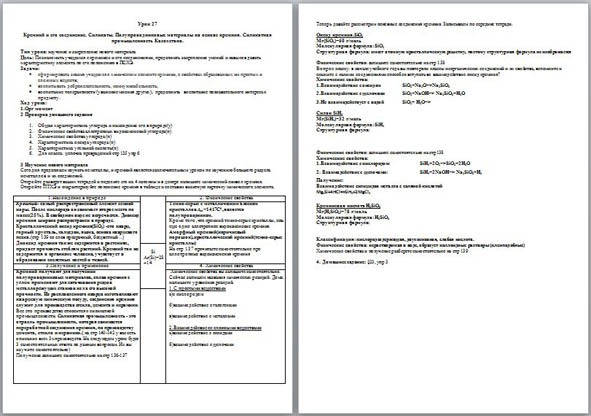
| 1.Нахождение в природе |
| 2. Физические свойства |
| Кремний- самый распространенный элемент земной коры. После кислорода он занимает второе место по массе(25%). В свободном виде не встречается. Диоксид кремния широко распространен в природе. Кристаллический оксид кремния(SiO2) -это кварц, горный хрусталь, халцедон, яшма, основа кварцевого песка.(стр 139 со слов прозрачный, бесцветный…) Диоксид кремния так же содержится в растениях, придает прочность стеблям растений. Кремний так же содержится в организме человека, учувствует в образовании скелетных костей и тканей. | Темно-серые с металлическим блеском кристаллов.tпл =1417С0 ,является полупроводником. Кроме того ,что кремний темно-серые кристаллы, есть еще одно аллотропное видоизменение кремния. Аморфный кремний(коричневый порошок),кристаллический кремний(темно-серые кристаллы) На стр 137 прочитаете самостоятельно про аллотропные видоизменения кремния |
|
Si Ar(Si)=28 +14
|
| 3.Получение и применение | 4. Химические свойства |
| Кремний получают для получении полупроводниковых материалов, сплав кремния с углем применяют для затачивания резцов металлорежущих станков из ха его высокой прочности. Из расплавленного кварца изготавливают кварцевую химическую посуду, соединения кремния служит для производства стекла, цемента и керамики. Все это производство относится к силикатной промышленности. Силикатная промышленность - это отрасль промышленности, которая занимается переработкой соединения кремния, по производству цемента, стекла и керамики.( на стр 140-142 у вас есть описание всех 3х производств. На следующем уроке будет 3 самостоятельных ответа по данным вопросам. Их вы изучите самостоятельно) Получение запишите самостоятельно на стр 136-137 | Химические свойства вы запишите самостоятельно. Сейчас запишем названия химических реакций. Дома напишите уравнения реакций. 1.С простыми веществами а)с кислородом
б)взаимодействие с галогенами
в)взаимодействие с металлами
2.Взаимодейсвие со сложными веществами а)взаимодействие с оксидами
б)взаимодействие с щелочами
|
|
|
Теперь давайте рассмотрим основные соединения кремния. Записываем по середине тетради.
Оксид кремния.SiO2
Mr(SiO2)=60 г/моль
Молекулярная формула: SiO2
Структурная формула: имеет атомную кристаллическую решетку, поэтому структурная формула не изображается
Физические свойство: запишите самостоятельно на стр 138
Вопрос классу: в начале учебного года вы повторяли классы неорганических соединений и их свойства, вспомните и скажите с какими соединениями способен вступать во взаимодействие оксид кремния?
Химические свойства:
1.Взаимодействие с оксидом SiO2+Na2O=Na2SiO3
2.Взаимодействие с щелочами SiO2+NaOH= Na2SiO3+H2O
3.Не взаимодействует с водой SiO2+ H2O=
Силан SiH4
Mr(SiH4)=32 г/моль
Молекулярная формула: SiH4
Структурная формула:
Физические свойство: запишите самостоятельно на стр138
Химические свойства:
1.Взаимодействие с кислородом: SiH4+2O2=SiO2+2H2O
2. Взаимодействие с щелочами: SiH4+2NaOH= Na2SiO3+H2
Получение:
Взаимодействие силицидов металла с соляной кислотой
Mg2Si+4HCl=SiH4+2MgCl2
Кремниевая кислота H2SiO3
Mr(H2SiO3)=78 г/моль
Молекулярная формула: H2SiO3
Структурная формула:
Классификация: кислородсодержащая, двухосновная, слабая кислота.
Физические свойства: нерастворимая в воде, образует коллоидные растворы (клеиподобные)
Химические свойства и получение разберете самостоятельно на стр 139
4. Домашнее задание: §23, упр 3

 Получите свидетельство
Получите свидетельство Вход
Вход












 Конспект урока химии "Кремний и его соединения. Силикаты. Полупроводниковые материалы на основе кремния. Силикатная промышленность Казахстана" (21.87 КB)
Конспект урока химии "Кремний и его соединения. Силикаты. Полупроводниковые материалы на основе кремния. Силикатная промышленность Казахстана" (21.87 КB)
 0
0 1038
1038 178
178 Нравится
0
Нравится
0


