
Классификация и свойства кислот ( химия, 8)
Учитель химии МБОУ «СШ №1» г. Остров, Псковская обл.
Петухова Т.Н.

Ожидаемые результаты:
Знать состав формул, определение кислот, индикаторов, физические и химические свойства кислот.
Совершенствовать учебные умения по составлению химических уравнений.
Способствовать развитию умений сравнивать, обобщать, делать выводы;
Развивать внимание, мышление и память.
Повторить и закрепить правила ТБ при работе с веществами. Воспитывать бережливое отношение к реактивам и оборудованию, дисциплинированность, аккуратность и умение работать в группе.

Кислоты: состав и строение
Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка.
H x An – общая формула
Кислота, когда здорова, Угостить друзей готова Тем, что ей дала природа - Катионом водорода!

Формула кислоты
Название кислоты
H 2 SO 4
Кислотный остаток
серная
HNO 3
H 2 S
Название кислотного остатка
= SO 4
азотная
H 3 PO4
сероводородная
- NO 3
сульфат
нитрат
= S
фосфорная
HCl
сульфид
= - PO4
соляная
H 2 CO 3
фосфат
- Cl
угольная
хлорид
= CO 3
карбонат

Классификация кислот
1. По содержанию кислорода.
КИСЛОТЫ
бескислородные
кислородсодержащие
HF HCl HBr
HNO3 H2SO4
HI H2S
H2CO3 H3PO4

КИСЛОТЫ
2. По количеству атомов водорода
одно-
основные
HCl
HNO3
трех-
основные
H3PO4
двухосновные
H2S
H2SO4

ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ
Тренажер 1
Попавшие на кожу капли раствора кислоты немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 2%-м раствором питьевой соды.
Едкое вещество—кислота! Разрушает и раздражает кожу, слизистые оболочки.

Физические свойства кислот
Жидкости, неограниченно смешивающиеся с водой:
H2SO4, HNO3, HCl …
Твердые вещества, растворимые в воде:
H3PO4? H3BO3
Твердые вещества, нерастворимые в воде:
H2SiO3
Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д .
Химические свойства кислот

Опыт 1
Изменяют цвет индикаторов
Лакмус
Индикатор
Фенолфта-
Нейтральная среда
Фиолетовый
Метиловый
Бесцветный
леин
Красный
Кислая среда
Бесцветный
оранжевый
Оранжевый
Розовый
6
1
2
3
5
4

Взаимодействуют с активными металлами
Опыт 2
кислота + ак. металл = соль + водород
Zn + 2 HCI = ZnCI 2 + H 2
Cu + HCI = реак. не идет
H 2
Zn
HCI
1
5
2
3
4
6
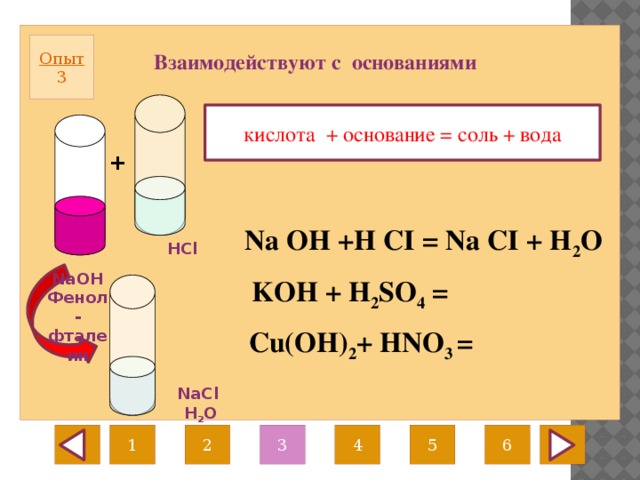
Опыт 3
Взаимодействуют с основаниями
кислота + основание = соль + вода
+
Na OH +H CI = Na CI + H 2 O
HCl
NaOH
Фенол-
фталеин
KOH + H 2 SO 4 =
Cu(OH) 2 + HNO 3 =
NaCl
H 2 O
2
5
1
3
4
6

Взаимодействуют с солями
Опыт 4
кислота + соль = н.соль +н. кислота ( )
+
BaCI 2 +H 2 SO 4 = BaSO 4 + 2HCI
H 2 SO 4
BaCI 2
HCl + CaCO 3 =
HNO 3 + Na 2 SO 3 =
Ba SO 4
HCI
1
3
2
4
6
5

Опыт 5
Взаимодействуют с оксидами металлов
(основными и амфотерными)
кислота + оксид = соль + вода
CuO + H 2 SO 4 = CuSO 4 + H 2 O
Zn O + HCl =
Cu O
Na 2 O + HNO 3 =
H 2 SO 4
Cu SO 4
H 2 O
3
1
4
5
2
6

Разложение кислот
Некоторые кислоты разлагаются при н.у. или при нагревании
CO2
H 2 CO 3 = H 2 O + CO 2
H 2 SO 3 = H 2 O + SO 2
H 2 SiO 3 = H 2 O + SiO 2
H 2 CO 3
6
1
2
3
5
4
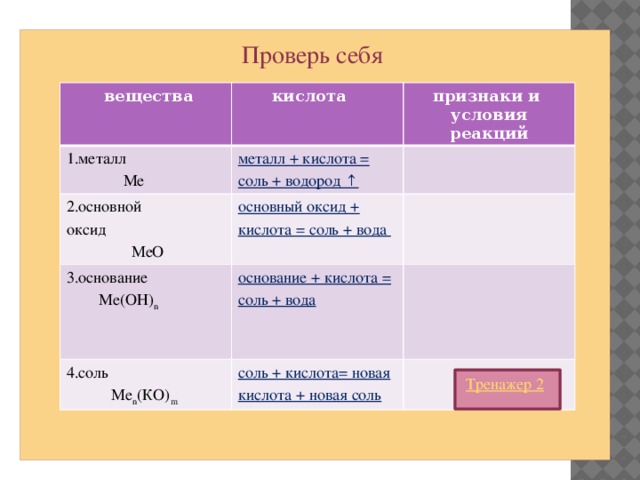
Проверь себя
вещества
кислота
1.металл
признаки и
Ме
металл + кислота = соль + водород ↑
2.основной
3.основание
основный оксид + кислота = соль + вода
условия реакций
оксид
МеО
Ме(ОН) n
основание + кислота = соль + вода
4.соль
Ме n (КО) m
соль + кислота= новая кислота + новая соль
Тренажер 2
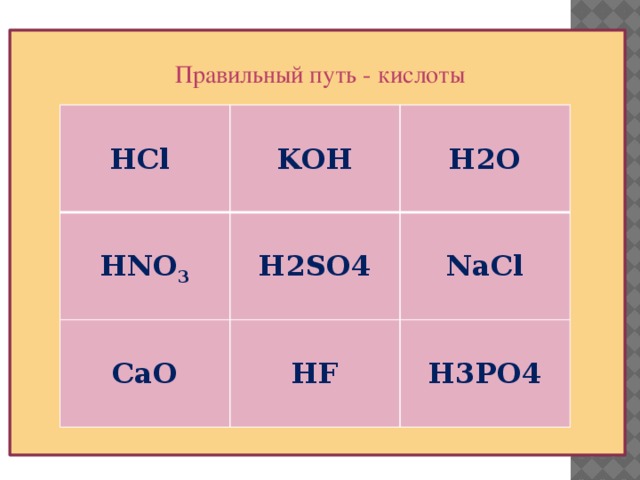
Правильный путь - кислоты
HCl
KOH
HNO 3
CaO
H2SO4
H2O
HF
NaCl
H3PO4

Домашнее задание
- § 32, упр.7 стр.104
- Подготовить сообщение о серной или соляной кислоте (по желанию)

Спасибо за работу

эор
Видеоопыты.
1. http://files.school-collection.edu.ru/dlrstore/273e6145-6cc8-fe8a-376e-9765c4e8a054/index.htm
(действие на индикатор)
2. http://files.school-collection.edu.ru/dlrstore/432f464f-1f22-5224-e016-91243ab1f09c/index.htm
( вз-ие с Ме)
3. http://files.school-collection.edu.ru/dlrstore/52f55b81-2186-f7fb-e965-75186329579b/index.htm
(вз-ие оксидами)
4. http://files.school-collection.edu.ru/dlrstore/c522a4f2-20e4-c15b-3543-acad60b247a3/index.htm
(вз-ие с солями)
5. http://experiment.edu.ru/attach/6/338.mov
(вз-ие с основаниями)
6. http://files.school-collection.edu.ru/dlrstore/0ab6f5aa-4185-11db-b0de-0800200c9a66/ch08_20_05.swf (ТБ)
7. http://files.school-collection.edu.ru/dlrstore/0ab6f5ad-4185-11db-b0de-0800200c9a66/index_mht.htm (формулы и названия кислот)

 Получите свидетельство
Получите свидетельство Вход
Вход











 «Классификация и свойства кислот» (250.03 KB)
«Классификация и свойства кислот» (250.03 KB)
 0
0 1717
1717 142
142 Нравится
0
Нравится
0


