
Кислоты
СПОСОБЫ ПОЛУЧЕНИЯ
И ХИМИЧЕСКИЕ СВОЙСТВА
презентация подготовлена
учителем химии ГБОУ СОШ № 2047
КОВАЛЕВОЙ Н.Ю.

Способы получения
1. Взаимодействие водорода с соответствующими неметаллами
H 2 + Cl 2 2HCl
2. Взаимодействие кислотных оксидов с водой
SO 3 + H 2 O H 2 SO 4
P 2 O 5 + H 2 O H 3 PO 4
3. Взаимодействие солей с кислотами
2NaCl + H 2 SO 4 Na 2 SO 4 + 2HCl

Химические свойства
1. Действие кислот на индикаторы
Индикаторы – вещества, которые под действием растворов кислот и щелочей меняют свой цвет
- Универсальный индикатор – краснеет
- Лакмус – краснеет
- Метиловый оранжевый становится розовым
Химические свойства
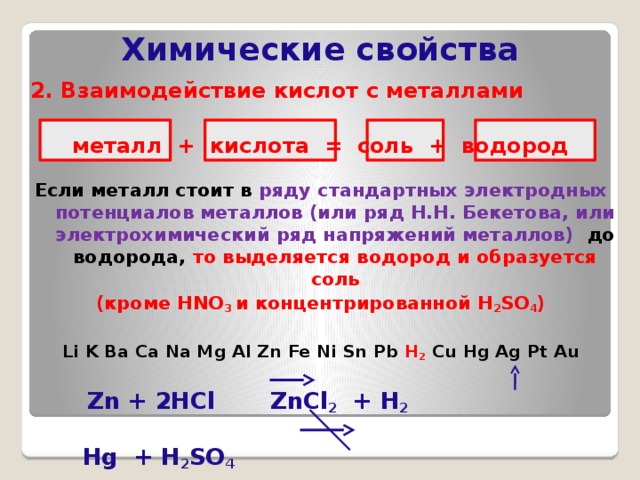
2. Взаимодействие кислот с металлами
металл + кислота = соль + водород
Если металл стоит в ряду стандартных электродных потенциалов металлов (или ряд Н.Н. Бекетова, или электрохимический ряд напряжений металлов) до водорода, то выделяется водород и образуется соль
(кроме HNO 3 и концентрированной H 2 SO 4 )
Li K Ba Ca Na Mg Al Zn Fe Ni Sn Pb H 2 Cu Hg Ag Pt Au
Zn + 2HCl ZnCl 2 + H 2
Hg + H 2 SO 4

Химические свойства
3. Взаимодействие кислот с основными оксидами:
основный + кислота = соль + вода оксид
CuO + H 2 SO 4 Cu SO 4 + H 2 O
BaO + 2HCl BaCl 2 + H 2 O

Химические свойства
4. Взаимодействие кислот с основаниями
основание + кислота = соль + вода
2KOH + H 2 CO 3 K 2 CO 3 + 2H 2 O
Mg(OH) 2 + H 2 S MgS + 2H 2 O
Химические свойства
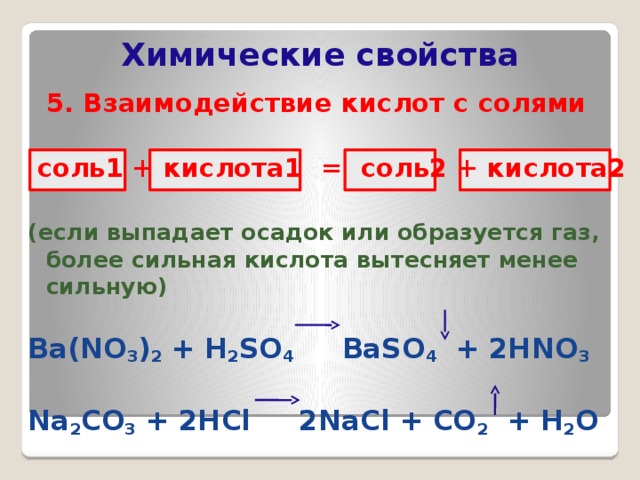
5. Взаимодействие кислот с солями
соль1 + кислота1 = соль2 + кислота2
(если выпадает осадок или образуется газ, более сильная кислота вытесняет менее сильную)
Ba(NO 3 ) 2 + H 2 SO 4 BaSO 4 + 2HNO 3
Na 2 CO 3 + 2HCl 2NaCl + CO 2 + H 2 O
Химические свойства
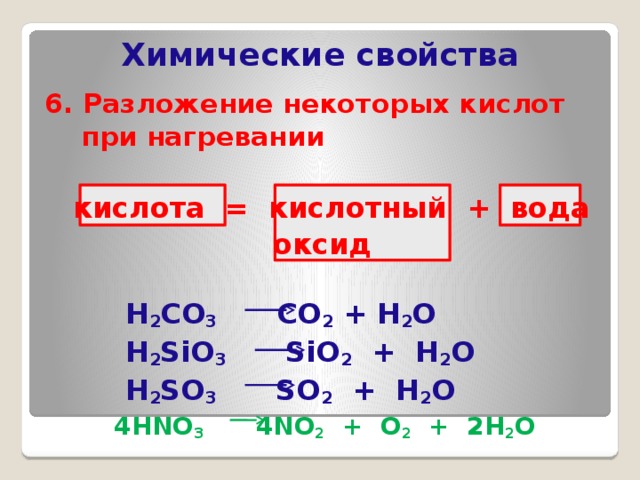
6. Разложение некоторых кислот при нагревании
кислота = кислотный + вода
оксид
H 2 CO 3 CO 2 + H 2 O
H 2 SiO 3 SiO 2 + H 2 O
H 2 SO 3 SO 2 + H 2 O
4HNO 3 4NO 2 + O 2 + 2H 2 O


 Получите свидетельство
Получите свидетельство Вход
Вход



















 Кислоты: способы получения и химические свойства (95.82 КB)
Кислоты: способы получения и химические свойства (95.82 КB)
 0
0 1956
1956 299
299 Нравится
0
Нравится
0


