
Подумайте! Какой класс химических веществ мы будем изучать?

Кислый вкус лимону придает лимонная кислота , яблоку — яблочная кислота, скисшему молоку — молочная кислота. Щавель имеет кислый вкус благодаря наличию в его листьях щавелевой кислоты.

Кислоты и их свойства
Цель урока:
Сформировать понятие о кислотах как классе электролитов, рассмотреть их общие свойства в свете ионных представлений.

Классификация кислот
по наличию кислорода
Бескислородные
Кислородсодержащие
HCl
HNO3
HF
H2SO4
H2CO3
HBr
H2SiO3
H 2 S
H3PO4
HI

Классификация кислот
по числу атомов водорода
Трехосновные
Одноосновные
Двухосновные
HF
HCl
HBr
HI
HNO3
HClO4
H3PO4
H3BO3
H2S
H2SO4
H2SO3
H2CO3
H2SiO3
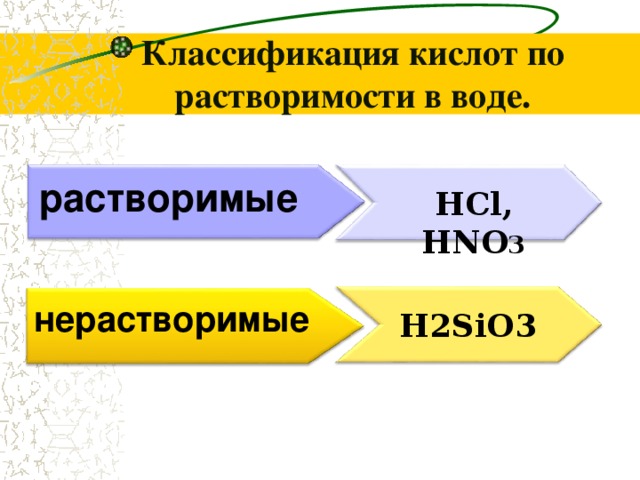
Классификация кислот по растворимости в воде.
растворимые
HCl, HNO 3
нерастворимые
H2SiO3
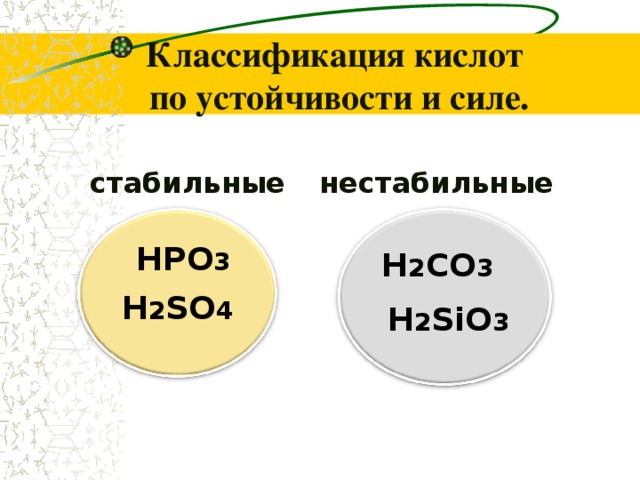
Классификация кислот по устойчивости и силе.
стабильные
нестабильные
HPO 3
H 2 СO 3
H 2 SiO 3
H 2 SO 4
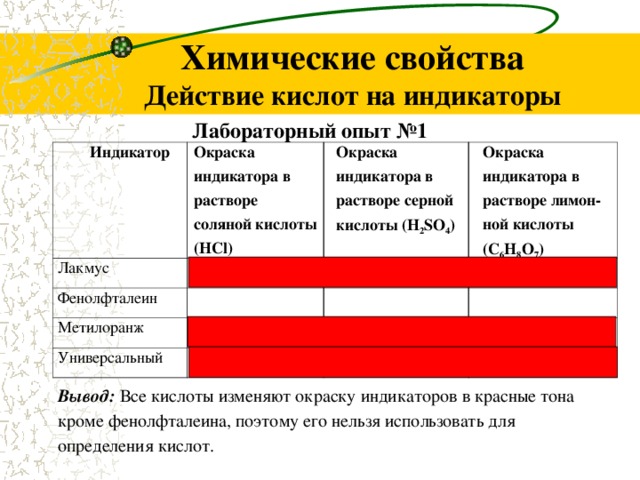
Химические свойства Действие кислот на индикаторы
Лабораторный опыт №1
Индикатор
Окраска индикатора в растворе соляной кислоты (HCl)
Лакмус
Окраска индикатора в растворе серной кислоты (H 2 SO 4 )
Фенолфталеин
Окраска индикатора в растворе лимон-ной кислоты (C 6 H 8 O 7 )
Метилоранж
Универсальный
Вывод: Все кислоты изменяют окраску индикаторов в красные тона кроме фенолфталеина, поэтому его нельзя использовать для определения кислот.

Химические свойства Взаимодействие с металлами
Лабораторный опыт №2
Сделайте вывод о том, все ли металлы реагируют с кислотой? С одинаковой ли скоростью протекают реакции. Сравните свои выводы с данными ряда активности металлов.
Запишите уравнения проведенных реакций опираясь на схему
Кислота + Ме = Соль + Н 2
По какому признаку мы можем судить, что эксперимент состоялся? Дополните высказывания, сделав вывод:
o Металлы стоящие в ряду электроотрицательности металлов после водорода ………………… с растворами кислот.
o Металлы стоящие левее в ряду электроотрицательности металлов ……… активны металлов стоящих правее.
не реагируют
более

Химические свойства Взаимодействие с основными оксидами
Лабораторный опыт №3
Задание: Исследовать отношение основных оксидов к кислотам
Проведение опыта и оформление результатов:
В пробирку поместите немного оксида меди (II), прилейте серной кислоты, закрепите в держателе и нагрейте содержимое пробирки.
Запишите уравнение проведенной реакции опираясь на схему:
Основной оксид + кислота = соль + Н 2 О

Химические свойства Взаимодействие с основаниями
Лабораторный опыт №4
Задание: Исследовать отношение щелочей и оснований к кислотам
В 1 пробирку налейте немного гидроксида натрия (NaOH), затем добавьте несколько капель фенолфталеина и нейтрализуйте соляной кислотой HCL. Посмотрите на изменение окраски, сделайте вывод о протекании химической реакции. Почему раствор снова стал бесцветным?
Во 2 пробирку налейте 1-2 мл гидроксида меди (II)( Cu(OH) 2 ), добавьте немного соляной кислоты HCL и слегка встряхните содержимое пробирки. Сделайте вывод о протекании химической реакции.
Запишите уравнения проведенных реакций в полном и сокращенном ионном виде опираясь на схему:
Основание + кислота = соль + Н2О

Химические свойства Взаимодействие с солями
Лабораторный опыт № 5
Задание: Исследовать отношение солей к кислотам.
В две пробирки прилейте соответственно растворы хлорида бария и карбоната натрия. Прилейте в обе пробирки серную кислоту. Что наблюдаете? Напишите уравнение химических реакций в полном и сокращенном ионном виде опираясь на схему.
Соль 1 + кислота 1 = соль 2 + кислота 2
Для написания уравнений реакций кислот с солями следует пользоваться рядом вытеснения кислот, в котором каждая предыдущая может вытеснить из соли последующую.
Ряд вытеснения кислот
HNO 3
Н 2 SO 4 HCl H 2 SO 3 H 2 CO 3 H 2 S H 2 SiO 3
H 3 PO 4
сильные кислоты слабые кислоты

Получение
Задание 1: Посмотрите пожалуйста на формулы бескислородных кислот (HCL, H 2 S, HF). Предложите самый простой способ их получения. Запишите реакцию на примере получения соляной кислоты.
Задание 2: Вспомните химические свойства оксидов. Как и из каких классов оксидов можно получить кислоты? Запишите реакцию получения серной кислоты.
3 . Слабые кислоты можно получить взаимодействием более сильных кислот с солями более слабых по отношению к ним солей:
2NaCL+H 2 SO 4 =2HCL+ Na 2 SO 4

2
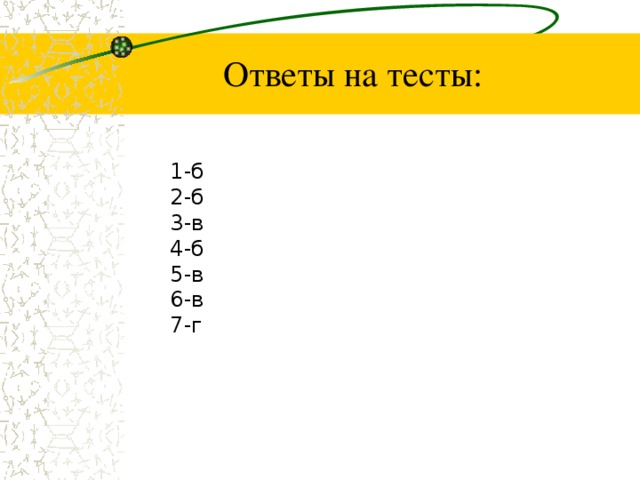
Ответы на тесты:
1-б
2-б
3-в
4-б
5-в
6-в
7-г

Д/з: параграф 38 Письменно на «3» - упр1,2,3 на «4» - упр1,2,3,4. на «5» - упр1,2,3,4,5 стр. 214.

БЛАГОДАРЮ ЗА УРОК ! УСПЕХА!


 Получите свидетельство
Получите свидетельство Вход
Вход




























 Кислоты и их свойства (презентация) (2.89 MB)
Кислоты и их свойства (презентация) (2.89 MB)
 0
0 1354
1354 151
151 Нравится
0
Нравится
0


