
приложение3
«Характеристика кислорода» Учитель: Никитина Татьяна Сергеевна

- Цель: формирование четкого представления о кислороде как элементе и кислороде как простом веществе
- План занятия:
- Распространенность кислорода в природе
- Характеристика кислорода – элемента
- Характеристика кислорода – простого вещества
- История открытия кислорода
- Способы получения кислорода
- Применение кислорода
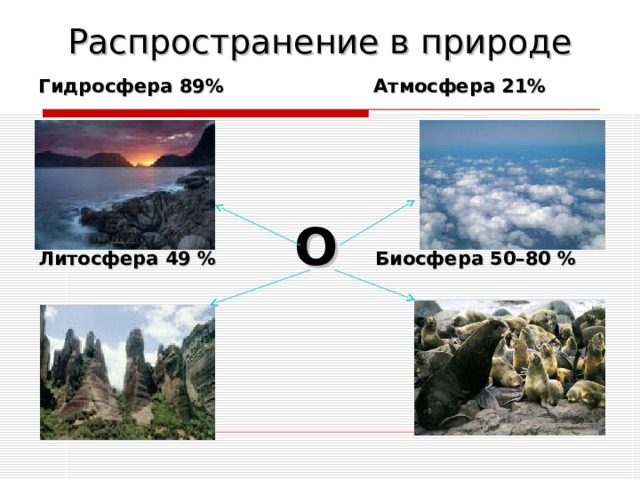
Распространение в природе
Гидросфера 89% Атмосфера 21%
Литосфера 49 % О Биосфера 50–80 %
Распространенность кислорода
Заполните кластер, используя учебник
Распространенность кислорода
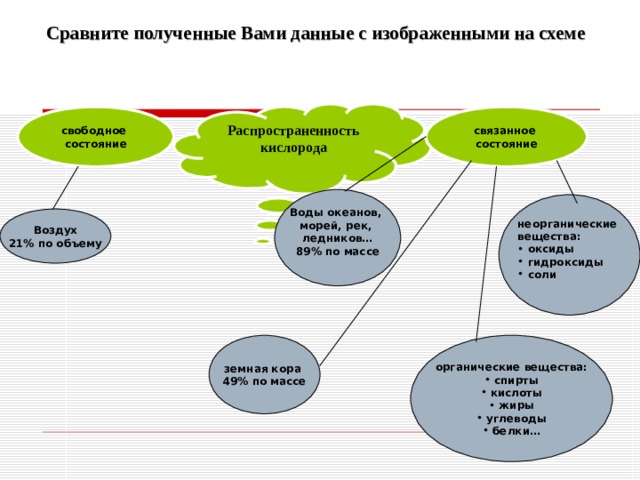
Сравните полученные Вами данные с изображенными на схеме
Распространенность кислорода
связанное
состояние
свободное
состояние
Воды океанов,
морей, рек,
ледников…
89% по массе
неорганические
вещества:
- оксиды
- гидроксиды
- соли
Воздух
21% по объему
органические вещества:
земная кора
49% по массе
- спирты
- кислоты
- жиры
- углеводы
- белки…

Кислород как элемент
1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер №8,
Ar = 1 6.
2. Строение атома:
P 1 1 = 8; n 0 1 = 8; ē = 8
валентность II , степень окисления -2
(редко +2; +1; -1).
3. Входит в состав оксидов, оснований, солей, кислот, органических веществ, в том числе живых организмов- до 65% по массе.
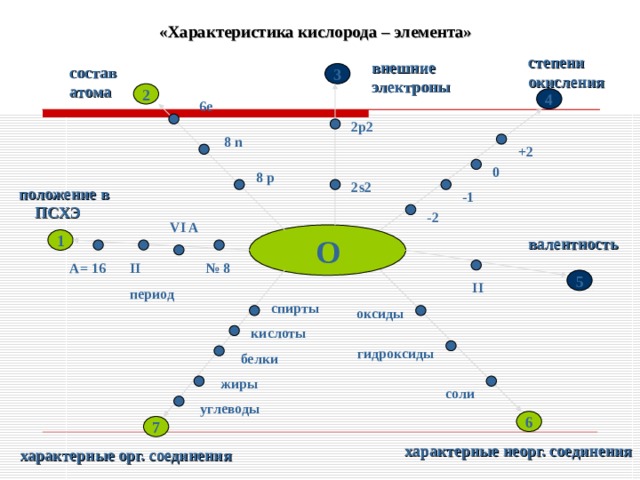
«Характеристика кислорода – элемента»
степени окисления
внешние электроны
состав атома
3
2
4
6е
2p2
8 n
+2
0
8 р
2 s2
положение в ПСХЭ
-1
-2
VI A
О
валентность
1
II
период
А= 16
№ 8
5
II
спирты
оксиды
кислоты
гидроксиды
белки
жиры
соли
углеводы
6
7
характерные неорг. соединения
характерные орг. соединения
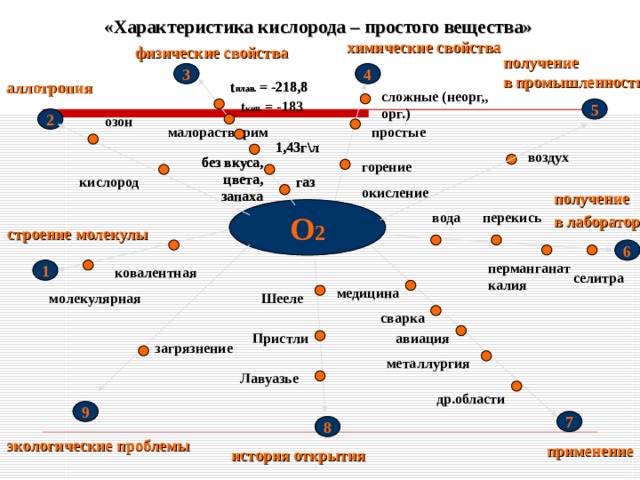
«Характеристика кислорода – простого вещества»
химические свойства
физические свойства
получение
в промышленности
4
3
t плав. = - 218,8
аллотропия
t плав. = - 218,8
сложные (неорг,, орг.)
t кип. = -183
5
2
озон
простые
малорастворим
1,43г\л
1,43г\л
воздух
без вкуса, цвета, запаха
без вкуса, цвета, запаха
горение
окисление
газ
кислород
газ
получение
в лаборатории
О 2
перекись
вода
строение молекулы
6
перманганат калия
ковалентная
1
селитра
медицина
молекулярная
Шееле
сварка
авиация
Пристли
загрязнение
металлургия
Лавуазье
др.области
9
7
8
экологические проблемы
применение
история открытия
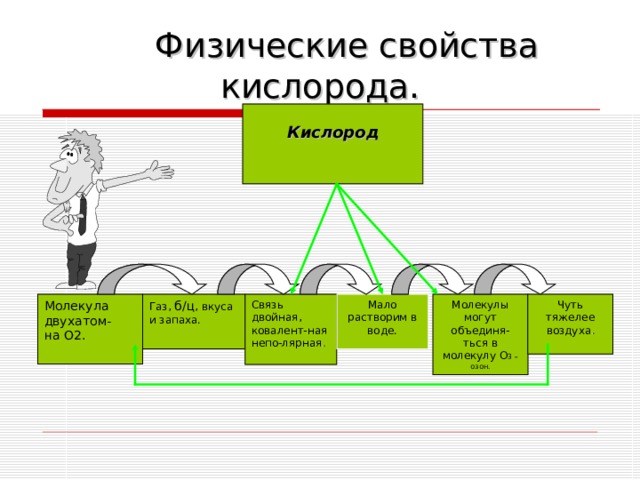
Физические свойства кислорода.
Кислород
Чуть тяжелее воздуха .
Молекулы могут объединя-ться в молекулу О 3 – озон.
Мало растворим в воде.
Связь двойная, ковалент-ная непо-лярная .
Газ, б/ц , вкуса и запаха.
Молекула двухатом-
на О2.
9

История открытия
1770 год
Карл Вильгельм Шееле
- нагревание селитры
- взаимодействие диоксида марганца с серной кислотой
- прокаливание перманганата калия
- разложение оксида серебра ( I )
Задание: напишите уравнения реакций способов получения кислорода, предложенных К.В.Шееле

1774 год
Джозеф Пристли
- прокаливание
оксида ртути ( II )
Задание: р ассчитайте объем кислорода, который мог бы получить Д.Пристли, если бы разложил 27,125 г оксида ртути ( II ), содержащего 20% примесей

1775 год
Антуан Лоран Лавуазье
- «огненный воздух»
- «жизненный воздух»
- «окси генес» - образующий кислоты
Задание: объясните каждое название кислорода, данное ему в ходе истории, с точки зрения современного химика

Опыты получения кислорода.

Проверка собравшегося кислорода

Получение О 2
Промышленный способ (перегонка жидкого воздуха).
Лабораторный способ (разложение некоторых кислородосодержащих веществ)
2KClO 3 – t ;MnO2 2KCl + 3O 2
2H 2 O 2 – MnO2 2H 2 O + O 2
П ерманганата калия при нагревании:
2KMnO 4 – t K 2 MnO 4 + MnO 2 + O 2
Разложение этой соли идёт при
нагревании её выше 200 0 С.

Способы получения и собирания кислорода
! Катализатор – вещество, изменяющее скорость реакции, но само при этом не расходующееся.
перманганата калия при нагревании:
2 KMnO 4 → K 2 MnO 4 + MnO 2 + O 2
Разложение этой соли идёт при нагревании её
выше 200 0 С.
Подумайте …
Как проверить, собрался ли кислород в сосуде?

- Находит широкое применение в медицине и промышленности.
- При высотных полётах лётчиков снабжают специальными приборами с кислородом.
- При многих лёгочных и сердечных заболеваниях, а также при операциях дают вдыхать кислород из кислородных подушек.

Кислородом в баллонах снабжают подводные лодки.
Горение рыхлого горючего материала, пропитанного жидким кислородом, сопровождается взрывом, что даёт возможность применять кислород при взрывных работах.
Жидкий кислород применяют в реактивных двигателях, в автогенной сварке и резке металлов, даже под водой.
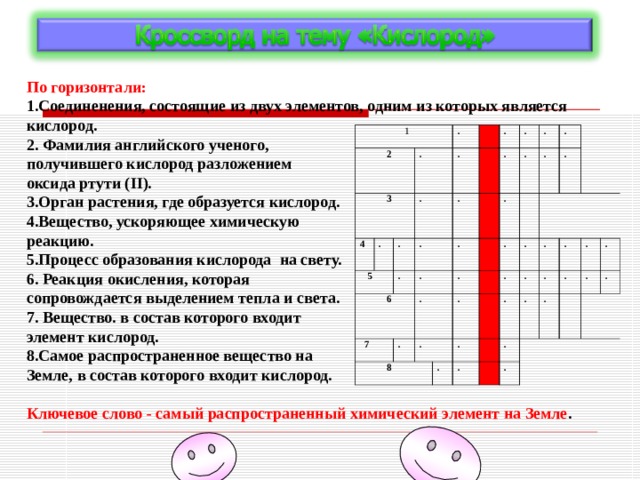
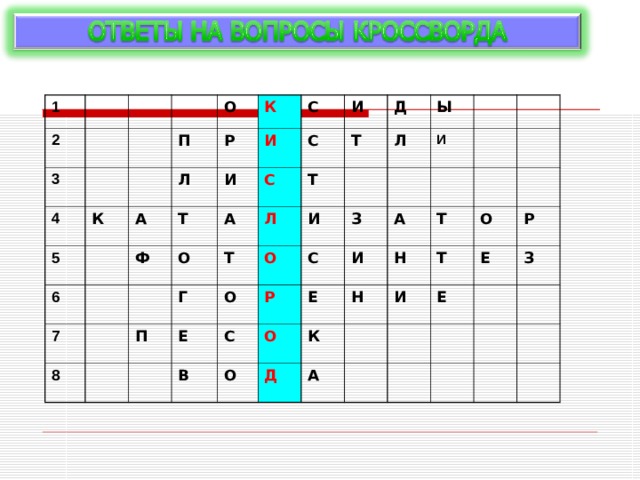
По горизонтали:
1.Соединенения, состоящие из двух элементов, одним из которых является кислород.
2. Фамилия английского ученого,
получившего кислород разложением
оксида ртути ( II ).
3.Орган растения, где образуется кислород.
4.Вещество, ускоряющее химическую
реакцию.
5.Процесс образования кислорода на свету.
6. Реакция окисления, которая
сопровождается выделением тепла и света.
7. Вещество. в состав которого входит
элемент кислород.
8.Самое распространенное вещество на
Земле, в состав которого входит кислород.
Ключевое слово - самый распространенный химический элемент на Земле .
1
2
3
4
5
.
.
.
.
6
.
.
7
.
.
.
.
.
.
8
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
1
2
3
4
5
О
П
К
6
А
Л
К
Р
Т
Ф
С
И
7
И
8
И
А
С
С
О
Т
Л
Г
Т
П
Д
Т
О
Е
Л
И
О
Ы
С
И
С
В
З
Р
О
О
И
Е
А
Н
Н
К
Т
Д
И
Т
А
О
Е
Е
Р
З

 Получите свидетельство
Получите свидетельство Вход
Вход











 "Характеристика кислорода" (1.45 MB)
"Характеристика кислорода" (1.45 MB)
 0
0 870
870 5
5 Нравится
0
Нравится
0









