ООО Учебный центр
«ПРОФЕССИОНАЛ»
Реферат по дисциплине:
По теме:
«Вода.
Исполнитель:
Слепнева Валентина Николаевна
д. Белово 2017 год
ОГЛАВЛЕНИЕ
Введение
Физические свойства
Химическое название воды
Виды воды Вода в природе Вода - роль воды в природе и жизни человека Список источниковВВЕДЕНИЕ
Вода - одно из самых удивительных веществ в природе, которое до конца еще не изучено. Мы много узнали о ней на уроках окружающего мира. Но не раз я уже слышала сочетание Святая вода. Святой водой, которая всегда имеется в нашем доме, лечат меня. Когда у меня болит голова или я чувствую недомогание, сразу выпиваю водички или умываюсь ей – и хворь отступает.
Что же это такое и чем она отличается? Заинтересовавшись этим вопросом, я и мои одноклассники решили побольше узнать об этом. Вместе с Ириной Васильевной мы составили план исследования
Цель работы: изучение свойств воды.
Задачи:
- Найти информацию воде.
Физические свойства
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (H2S, CH4, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте). Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода[11]. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования[11]. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °С, а замерзала при −100 °С[12].
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель. Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| Температура | Удельная теплоёмкость воды |
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
Капля, ударяющаяся о поверхность воды
Чистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония H3O+) и гидроксильных ионов OH− составляет 10-7 моль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть присутствуют другие положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Агрегатные состояния
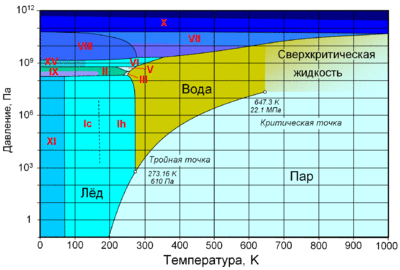
Фазовая диаграмма воды: по вертикальной оси — давление в Па, по горизонтальной — температура в Кельвинах. Отмечены критическая (647,3 K; 22,1 МПа) и тройная (273,16 K; 610 Па) точки. Римскими цифрами отмечены различные структурные модификации льда
Основные статьи: Водяной пар, Лёд, Фазовая диаграмма воды
По состоянию различают:
«Твёрдое» — лёд
«Жидкое» — вода
«Газообразное» — водяной пар

Типы снежинок.
При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт[18]:
| Давление, атм. | Ткип, °C |
| 0,987 (105 Па — нормальные условия) | 99.63 |
| 1 | 100 |
| 2 | 120 |
| 6 | 158 |
| 218,5 | 374,1 |
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Физические основы гидрологических явлении и процессов (по А. И. Чеботареву) Основные физические свойства воды, снега и льдаОбщие сведения. Вода имеет большое значение в жизни Земли. Являясь одним из распространенных и наиболее подвижных природных тел, она участвует почти во всех физических, климатических и биологических процессах, совершающихся на Земле.
При анализе гидрологических явлений принимается, что количество свободной воды на Земле сохраняется постоянным. Вода в результате некоторых процессов вступает в прочные соединения с другими веществами и перестает существовать как свободное образование, однако в глубоких слоях земной коры имеют место и обратные процессы: при высоких давлениях и температурах вновь образуется некоторое количество воды.
Жидкая вода в тонких слоях бесцветна, в толстых имеет голубовато-зеленый оттенок. Чистая вода, без примесей, почти не проводит электрический ток. Температура замерзания дистиллированной воды принята за 0° С, а температура кипения при нормальном давлении - за 100° С.
Природная вода никогда не бывает совершенно чистой. Наиболее химически чистой является дождевая вода, но и она содержит различные примеси, которые захватывает из воздуха. Попадая на землю, дождевая вода отчасти стекает по поверхности, отчасти просачивается в почво-грунты, образуя подземные воды. Стекая по поверхности земли и в толще почво-грунтов, вода растворяет различные вещества и превращается в раствор. Качественный и количественный характер изменений химического состава растворенных веществ и физических свойств воды весьма различен и зависит от всего комплекса физико-географических условий, в которых совершается процесс круговорота воды на Земле.
Строение воды. Вода состоит из 11,11% водорода и 88,89% кислорода (по весу). При образовании воды с одним атомом кислорода соединяются два атома водорода. В молекуле воды атомы водорода и кислорода расположены по углам равнобедренного треугольника: при вершине находится атом кислорода, а в углах при основании - по атому водорода; угол при вершине треугольника около 105°, а расстояние между ядрами водорода и кислорода около 0,97*10-8 см и между ядрами водорода 1,53*10-8 см (рис.7).
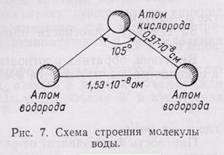
Молекула воды характеризуется значительной полярностью вследствие того, что в ней оба атома водорода располагаются не на прямой, проведенной через центр атома кислорода, а как бы по одну сторону от атома кислорода. Это приводит к неравномерности распределения электрических зарядов. Сторона молекулы с атомом кислорода имеет некоторый избыток отрицательного заряда, а противоположная сторона, в которой размещены атомы водорода, - избыток положительного заряда электричества. Наличием полярности и некоторых других сил обусловлена способность молекул воды объединяться в агрегаты по несколько молекул.
Простейшую формулу H2O имеет молекула парообразной воды. Молекула воды в жидком состоянии представляет собой объединение двух простых молекул (Н2O)2, молекула льда - объединение трех простых молекул (Н20)3. Простая, не объединившаяся с другой молекула воды Н20 называется гидроль, образование из двух объединившихся молекул воды, т. е. (Н20)2, - дигидроль, а соединение из трех простых молекул (Н20)3 - тригидроль. Образование дигидроля и тригидроля происходит вследствие притяжения молекул воды друг к другу в результате отмеченного выше эффекта полярности, свойственного молекулам воды.
Во льду преобладают молекулы тригидроля, имеющие наибольший объем, а простые, необъединившиеся молекулы в нем отсутствуют. В парообразном состоянии при температуре свыше 100° С, вода состоит главным образом из молекул гидроля, так как значительная скорость движения молекул при этой температуре нарушает ассоциацию (объединение) молекул. В жидком состоянии вода представляет собой смесь гидроля, дигидроля и тригидроля, соотношение между которыми меняется с изменением температуры. Между формами молекул воды в зависимости от температуры установлено следующее соотношение (в процентах):
| Форма молекулы | Лед | Вода | |||
| 0ºС | 4ºС | 38ºС | 98ºС | ||
| H2O | 0 | 19 | 20 | 29 | 36 |
| (H2O)2 | 41 | 58 | 59 | 50 | 51 |
| (H2O)3 | 59 | 23 | 21 | 21 | 13 |
Существует и вторая модель строения воды. Исследование воды при помощи спектрального анализа показывает, что структура расположения кристаллов в молекуле воды при температурах ниже 4° С, включая и фазу льда, сходна со строением кристалла тридимита, а при более высоких температурах - со строением кристалла кварца. При понижении температуры кварцевая структура воды постепенно замещается тридимитовой. Принимая во внимание, что лед по структуре сходен с тридимитом (т. е. подобен графиту), и предполагая, что строение воды подобно строению кварца (т. е. алмаза), можно понять, что замещение одной структуры другой приводит к возникновению аномалий воды, в частности к уменьшению плотности при замерзании.
Плотность и удельный объем. Под плотностью воды понимается отношение ее массы m к объему V, занимаемому ею при данной температуре. За единицу плотности принята плотность дистиллированной воды при 4° С.
Величина, обратная плотности, т. е. отношение единицы объема к единице массы, называется удельным объемом:
v = V/m где v - в см3/г.
Плотность воды зависит от ее температуры, минерализации, давления, количества взвешенных частиц и растворенных газов. С повышением температуры плотность всех жидкостей, как правило, уменьшается. Вода в этом отношении ведет себя аномально: при температурах выше 4° С плотность ее с повышением температуры уменьшается, а в интервале температур 0-4° С увеличивается. Аномальное изменение плотности воды объясняется особенностями ее строения. При нагревании воды идут два параллельных процесса: первый - нормальное увеличение объема за счет увеличения расстояния между молекулами, второй - уменьшение объема благодаря возникновению более плотных гидролей и дигидролей.
В зоне температур выше 4° С интенсивнее происходит первый процесс, в интервале 0-4°С - второй. В момент выравнивания влияния, оказываемого этими процессами на изменение объема воды, наступающего при 4° С, наблюдается наибольшая плотность, С точки зрения структурной модели строения воды аномальное изменение плотности при изменениии температуры объясняется постепенной заменой при повышении температуры от 0 до 4° С тридимитовой рыхлой упаковки более плотной кварцевой.
Изменения плотности воды на один градус температуры в различных интервалах температуры неодинаковы. Они очень малы около температуры наибольшей плотности и быстро возрастают по мере удаления от нее. Так, при температуре, близкой к 4°С, изменение плотности воды на один градус температуры составляет 8*10-6, при температуре около 30°С - до 3*10-4.
При переходе воды из жидкого состояния в твердое (лед) плотность резко, скачкообразно изменяется приблизительно на 9%; плотность дистиллированной воды при 0°С равна 0,99987, а плотность льда, образовавшегося из той же воды при 0°С, равна 0,9167.
С понижением температуры плотность чистого льда несколько возрастает и при -20° С достигает 0,92.
Своеобразный режим изменения плотности воды в связи с изменениями температуры имеет колоссальное значение в природе. Благодаря этому естественные водоемы (например, озера) при отрицательных температурах воздуха зимой даже в условиях сурового климата не промерзают до дна в случае достаточной глубины водоема. При этом под ледяным покровом остается жидкая вода, потому что при промерзании лед, значительно более легкий, чем вода, остается на поверхности водоема, на дно которого опускаются охладившиеся до 4°С наиболее плотные массы воды.
Изменение плотности воды оказывает существенное влияние на режим водоемов, вызывая конвекционные токи и течения, стремящиеся выровнять возникшую неравномерность в распределении плотности.
Плотность снега в гидрометеорологии выражается в виде отношения веса снега к весу воды, взятых в равных объемах, или отношения веса снега Р в граммах к его объему W в кубических сантиметрах
с = P/W
Слой воды hв, содержащийся в снеге, выражается как произведение высоты снега hс на его плотность с, т. е. hв = с*hс. С плотностью снега непосредственно связаны пористость, теплопроводность, водоудерживающая способность, твердость и другие механические и водно-физические свойства снежного покрова.
Плотность снега колеблется в широких пределах как по времени, так и по площади. Наименьшей плотностью, порядка 0,01 г/см3, обладает свежий снег, выпавший при низкой температуре и безветренной погоде. С течением времени под влиянием ветра и оттепелей снег уплотняется. Сильно промокший и затем смерзшийся снег обладает плотностью до 0,70 г/см3.
В районах с устойчивым снежным покровом обнаруживается некоторая закономерность увеличения плотности снега к началу таяния в направлении с севера на юг. Так, на севере Европейской территории России плотность снега в конце зимы находится в пределах 0,22-0,28 г/см3, в средней полосе - в пределах 0,24- 0,32 г/см3. На юге она изменяется в широких пределах - от 0,22- 0,23 в районах, не подвергшихся действию оттепелей, до 0,34- 0,36 г/см3 при наличии зимних оттепелей.
Плотность снега в начале таяния изменяется в среднем от 0,18 до 0,35, в период интенсивного таяния от 0,35 до 0,45 и в конце таяния доходит до 0,50. Плотность снега в лесу в среднем на 10-15% меньше, чем на открытых участках. Для северных и северозападных районов, где влияние оттепелей на плотность снега сравнительно невелико, отмечается прямая связь плотности с высотой снежного покрова. Это позволяет устанавливать эмпирические зависимости непосредственно между запасом воды в снежном покрове и его высотой.
В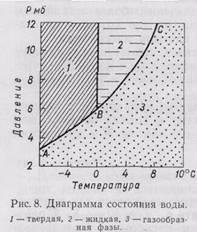 озможность перехода воды из одного агрегатного состояния в другое (из жидкого в лед или в пар и обратно) определяется температурой и давлением. Диаграмма состояния воды изображена на рис. 8. Линия АВ показывает границу равновесия между парообразной и твердой водой, линия ВС - между парообразной и жидкой водой. При температуре 0,0075°С и давлении 6,1 мб в устойчивом равновесии могут одновременно существовать лед, пар и жидкая вода (точка В на графике).
озможность перехода воды из одного агрегатного состояния в другое (из жидкого в лед или в пар и обратно) определяется температурой и давлением. Диаграмма состояния воды изображена на рис. 8. Линия АВ показывает границу равновесия между парообразной и твердой водой, линия ВС - между парообразной и жидкой водой. При температуре 0,0075°С и давлении 6,1 мб в устойчивом равновесии могут одновременно существовать лед, пар и жидкая вода (точка В на графике).
Если очень чистую воду охлаждать, тщательно предохраняя ее от сотрясения, то лед долго не образуется, несмотря на низкую температуру; практически такое охлаждение производилось до -72° С. Однако переохлажденная вода малоустойчива: при внесении в нес кристаллика льда или при встряхивании она сразу же превращается в лед. Переохлаждение воды в естественных водоемах на 0,005-0,01° С встречается весьма часто. В грунтах вследствие повышенной минерализации переохлаждение воды может быть более значительным.
Удельная теплота парообразования воды и плавления снега и льда. Удельной теплотой парообразования L называется количество тепла, необходимое для перевода 1 г воды из жидкого состояния в парообразное без изменения температуры при нормальном атмосферном давлении. Скрытая теплота испарения воды при 0°С равна 597 кал/г, при температуре 100°С - 539 кал/г, или 2,23*106 Дж/кг. При переходе водяного пара в жидкую воду выделяется такое же количество тепла. Теплота, затрачиваемая на перевод жидкости в пар, состоит из двух частей
L = L1 + L2,
где L1 - тепло, расходуемое на преодоление межмолекулярных сил сцепления, т. е. на повышение внутренней энергии, и называемое внутренней теплотой испарения; L2 - тепло, расходуемое на увеличение объема, занимаемого единицей массы вещества, т. е. на работу против внешнего давления.
При температуре испаряющей поверхности 10° С на работу против внешнего давления тратится около 5% удельной теплоты парообразования, а остальные 95% - на повышение внутренней энергии.
С повышением температуры удельная теплота парообразования уменьшается. Эта зависимость может быть охарактеризована следующей эмпирической формулой:
L = 597 - 0,57t.
где t - температура испаряющей позерхности, L - в кал/г.
Количество тепла, затрачиваемого на испарение столбика воды высотой E см с площадью основания 1 см2 при плотности воды = 1, определяется по формуле
Qис = EL = Е (597 - 0,570 t),
где Qис - в калориях.
Удельной теплотой плавления Lпл называется количество тепла, поглощаемого при переходе 1 г снега или льда в жидкую воду той же температуры. Это же количество тепла выделяется при замерзании 1 г воды. Удельная теплота плавления чистого льда равна 79,9 кал/г при 0° С и нормальном атмосферном давлении.
Количество теплоты, поглощаемое при плавлении или выделяемое при кристаллизации столбиком чистого льда высотой h см и площадью 1 см2, определяется выражением
Qл = pлhLпл,
где Qл- в калориях.
Интересно отметить, что удельная теплота испарения воды и удельная теплота плавления льда значительно больше, чем многих других жидкостей. Эта аномалия объясняется, так же как и аномалия плотности, особенностями строения воды. При переходе жидкой воды в пар и льда в жидкую воду энергия затрачивается не только на преодоление сил взаимного притяжения молекул, но и на разрушение агрегатов двойных и тройных молекул.
Удельная теплота испарения льда и снега при 0° С и нормальном атмосферном давлении равна сумме удельной теплоты плавления льда (79,9 кал/г) и удельной теплоты испарения воды (597 кал/г), т. е. 677 кал/г. Это непосредственно следует из закона сохранения энергии. Действительно, частица льда может либо непосредственно перейти в пар (возгонка), либо сначала перейти в жидкость, а затем уже из жидкости в пар. Так как в обоих случаях начальное и конечное состояние системы одинаково, то изменение энергии должно быть одинаковым.
Количество тепла, затрачиваемого на испарение воды с естественных водоемов, составляет большую долю их теплового баланса; в условиях средних и южных широт России это 40-75% общего количества.
Теплоемкость и теплопроводность. Количество тепла, необходимое для нагревания 1 г воды на 1°С, называется удельной теплоемкостью. В гидрологии теплоемкость обычно выражается в кал/(г*град). Вода характеризуется наибольшей теплоемкостью по сравнению с другими жидкими и твердыми веществами, за исключением водорода и аммиака.
Благодаря большой теплоемкости воды суточные и сезонные изменения ее температуры оказываются менее значительными, чем изменение температуры воздуха, удельная теплоемкость которого в 4 раза меньше, чем теплоемкость воды. Так же как и плотность, теплоемкость воды изменяется с температурой аномально: при 30°С она наименьшая - 0,9975 кал/(г*град) при 15 и 70°С равна 1,000, при 3,6 и 100°С возрастает до 1,0057; теплоемкость водяного пара при 100°С и давлении 760 мм равна 0,462, теплоемкость льда при 0°С - 0,485, а при 10°С - 0,444 кал/(г*град).
Передача тепла путем молекулярной теплопроводности состоит в том, что повышенные колебания молекул в более нагретых слоях постепенно передаются молекулам смежных слоев и таким образом энергия теплового движения постепенно передается от слоя к слою. В результате возникает поток тепла от более нагретых слоев к слоям с более низкой температурой.
Коэффициент теплопроводности воды при 0° С равен 0,001358 кал/(см*с*град). С повышением температуры он увеличивается и при температуре 20° С равен 0,00143 кал/(см*с*град). Вследствие малых значений коэффициента молекулярной теплопроводности перенос тепла с помощью описанного механизма не играет существенной роли в термическом режиме водных объектов. В природных условиях решающую роль при переносе тепла в воде играют турбулентные процессы.
Коэффициент теплопроводности чистого, лишенного пузырьков воздуха льда равен 0,0054 кал/(см*с*град). С понижением температуры теплопроводность льда несколько уменьшается. Теплопроводность снега зависит в значительной мере от его плотности.
Молекулярная вязкость. Поверхностное натяжение. Вязкостью жидкости называется ее свойство оказывать сопротивление взаимному передвижению смежных слоев. Вязкость играет двойную роль при движении жидкости. С одной стороны, она выступает как фактор, формирующий скоростное поле потока, передающий скорости от одного слоя к другому, сглаживающий различие скоростей в соседних точках, а с другой - как фактор, оказывающий сопротивление движению, т. е. способствующий превращению механической энергии в тепловую. Влияние молекулярной вязкости на сопротивление движению воды в естественных условиях в большинстве случаев является малым и им можно пренебречь. В этих условиях основные потери энергии возникают вследствие преодоления сопротивлений, возникающих в результате неупорядоченного, вихревого характера течения воды.
Коэффициент вязкости воды зависит от температуры: с повышением температуры он значительно уменьшается.
Силы притяжения, действующие между молекулами воды, вызывают на поверхностях раздела вода - воздух - твердое тело явление, называемое поверхностным натяжением. Оно проявляется на границе раздела вследствие разности сил молекулярного притяжения, так как поверхностные молекулы испытывают притяжение, направленное к массе воды, большее, чем в направлении парообразных частиц воды, находящихся в воздухе.
Каждая молекула, расположенная под поверхностью на глубине, большей, чем радиус сил молекулярного притяжения (примерно 5*10-6 см), окружена со всех сторон молекулами воды, действующими на нее с некоторыми силами. Благодаря симметричному расположению эти силы будут компенсироваться. Когда молекула попадает в поверхностный слой воды толщиной, равной радиусу сил молекулярного притяжения, возникает равнодействующая молекулярных сил, направленная внутрь жидкости. Этот радиус превышает радиус самих молекул, но ненамного, так как силы молекулярного притяжения с увеличением расстояния быстро затухают.
В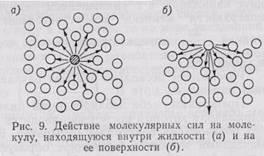 ода характеризуется очень большим поверхностным натяжением: при 0°С - 75,5 дн/см, при 100°С - 57,15 дн/см. Все жидкости при обычной температуре, за исключением ртути, обладают во много раз меньшим поверхностным натяжением. На границе соприкосновения с твердым телом вода смачивает его поверхность, а действие силы поверхностного натяжения при водит к тому, что поверхность воды в непосредственной близости к твердому телу искривляется, несколько приподнимаясь. Если соприкосновение воды с твердыми стенками происходит в порах или пустотах достаточно большого диаметра, то основная, центральная часть поверхности заключенной в них воды остается плоской. Если же диаметр пор и пустот настолько мал, что он делается соизмеримым с радиусом кривизны пристенного искривления поверхности воды, то искривленные края с обеих сторон сливаются и образуют вогнутый мениск. Практически верхняя граница диаметра пор и пустот, в которых наблюдается образование менисков, измеряется несколькими миллимет-рами. Чем меньше диаметр пор, тем больше кривизна мениска, т. е. тем меньше радиус кривизны.
ода характеризуется очень большим поверхностным натяжением: при 0°С - 75,5 дн/см, при 100°С - 57,15 дн/см. Все жидкости при обычной температуре, за исключением ртути, обладают во много раз меньшим поверхностным натяжением. На границе соприкосновения с твердым телом вода смачивает его поверхность, а действие силы поверхностного натяжения при водит к тому, что поверхность воды в непосредственной близости к твердому телу искривляется, несколько приподнимаясь. Если соприкосновение воды с твердыми стенками происходит в порах или пустотах достаточно большого диаметра, то основная, центральная часть поверхности заключенной в них воды остается плоской. Если же диаметр пор и пустот настолько мал, что он делается соизмеримым с радиусом кривизны пристенного искривления поверхности воды, то искривленные края с обеих сторон сливаются и образуют вогнутый мениск. Практически верхняя граница диаметра пор и пустот, в которых наблюдается образование менисков, измеряется несколькими миллимет-рами. Чем меньше диаметр пор, тем больше кривизна мениска, т. е. тем меньше радиус кривизны.
При образовании вогнутого мениска давление на его поверхности за счет сил поверхностного натяжения оказывается меньше, чем давление на плоской поверхности воды. Связь между поверхностным давлением при плоской поверхности Р0 и давлением на вогнутом мениске P1 выражается соотношение
Р0 = P1 + 2a/R,
где а- поверхностное натяжение; R- Р0 - P1 = 2a/R может быть названа менисковой силой. В результате возникновения менисковой силы на границе сплошного слоя воды образуется превышение поверхностного давления над давлением в порах или капиллярах, которое и является причиной подъема воды в капиллярах. Подъем будет происходить до тех пор, пока гидростатическое давление образовавшегося в капилляре столбика воды не уравновесит менисковую силу. Высота подъема обратно про-порциональна радиусу капилляра, так как радиус кривизны поверхности мениска R тем меньше, чем меньше радиус капилляра, а с уменьшением радиуса кривизны поверхности мениска возрастает менисковая сила.
Поглощение и рассеяние водой (снегом, льдом) солнечной энергии. Солнечная энергия, поступающая к поверхности воды (снега, льда), частично проникает в воду и поглощается ею, частично отражается. Поглощенная лучистая энергия превращается в тепловую.
Количество отражаемой от поверхности воды прямой солнечной радиации зависит от угла падения лучей или высоты солнца; отражение рассеянной радиации от высоты солнца не зависит и происходит по другим законам. Отношение отраженной солнечной энергии к поступающей носит название коэффициента отражения, или альбедо. При больших высотах солнца, порядка 30-80°, от гладкой поверхности воды отражается только 6-2% энергии; при уменьшении высоты солнца количество отраженной энергии быстро возрастает и при угле 15° составляет 21,5%, при 10° - 35%, а при 1° - от поверхности воды отражается 90% падающей на нее прямой солнечной радиации. Коэффициент отражения рассеянной радиации для водной поверхности составляет 5-10%, увеличиваясь с убыванием потока рассеянной радиации.
Отражательная способность снега и льда, помимо высоты солнца, зависит от их структуры, степени загрязненности и пр.
В среднем для условий Европейской территории СССР альбедо снежного покрова для свежевыпавшего сухого снега составляет 0,82, а для мокрого 0,50. Коэффициент отражения в период снеготаяния быстро изменяется от 0,70-0,82 в начале до 0,30 в конце снеготаяния; он закономерно убывает вместе с уменьшением высоты снега и скачкообразно возрастает при каждом новом снегопаде. Наиболее быстро коэффициент отражения уменьшается с уменьшением высоты при небольшой толщине снежного покрова (до 10 см), медленнее - при высоте от 10 до 30 см и остается почти неизменным при высоте 40-50 см.
Поглощение солнечной энергии изменяется в зависимости от длины световой волны и наличия в воде взвешенных и растворенных веществ. Наибольшего значения он достигает в инфракрасной части спектра (длина волны более 0,76 мкм); наименьшие его значения приходятся на видимую световую часть спектра (длина волны от 0,40 до 0,76 мкм). В ультрафиолетовой части спектра (длина волны менее 0,40 мкм) коэффициент поглощения снова возрастает. Таким образом, вода хуже пропускает инфракрасные лучи и лучше световые (видимые) лучи, которые, проникая вглубь, обусловливают освещенность воды. В видимой части спектра (длина волны от 0,40 до 0,76 мкм) более интенсивно поглощается длинноволновое излучение.
В зависимости от коэффициента поглощения, изменяющегося с изменением длин световых волн, на различные глубины проникает разное количество солнечной энергии. После прохождения слоя воды 1,0 см все лучи в спектре с длиной волны более 1,5 мкм полностью поглощаются; на глубину 1,0 см проникает 74% поступающей солнечной энергии, на глубину 100 см - 36%, а до глубины 10 м доходит 18%; остальная часть солнечной энергии поглощается вышележащим слоем воды и расходуется на нагревание.
Рассеяние света происходит как в самой водной массе, так и под влиянием взвешенных в ней частиц. Чем длиннее волна, тем она меньше рассеивается; поглощаются же, наоборот, сильнее длинные волны и слабее короткие. Иначе говоря, сильнее рассеивается и менее поглощается коротковолновая сине-фиолетовая часть спектра и, наоборот, меньше рассеиваются и больше поглощаются красные лучи.
Совокупным действием поглощения и рассеяния объясняется цвет воды природных водоемов. Вследствие того что фиолетовые и синие лучи поглощаются в меньшей степени, чем красные, и в большей степени рассеиваются, цвет воды отличается синеватым и сине-зеленоватым оттенками.
Некоторые характеристики физических свойств снега. Структура снега бывает относительно простой непосредственно после его выпадения: в последующем под влиянием ветрового переноса, оттепелей и собственного веса снега она подвергается весьма значительным изменениям. Вместе с ней изменяются и другие физические характеристики снега.
В снежном покрове, залегающем на земной поверхности, помимо ледяных кристаллов снега, содержится также воздух, а иногда и жидкая вода.
Весовое содержание заключенного в снежном покрове воздуха мало и лишь при плотностях снега менее 0,10 г/см3 оно составляет несколько процентов от веса снега. Напротив, объем воздуха в снежном покрове весьма велик. Принимая плотность льда равной 0,916 г/см3, получим, что при плотности снежного покрова 0,46 г/см3 занимаемые в нем воздухом и льдом объемы равны. При плотности менее 0,46 г/см3 объем содержащегося в снежном покрове воздуха превышает объем льда в несколько раз и становится меньше последнего лишь при плотностях более 0,46 г/см3.
Изменение структуры снежного покрова связано с изменением с течением времени со-стояния и структуры ледяных (снежных) кристаллов. Снег, выпадающий в безветренную погоду, состоит из разнообразных по форме ледяных звездочек, хлопьев или тончайших игл. Эти первичные ледяные образования, хаотически и непрочно соединяясь между собой, создают рыхлый с малой плотностью свежевыпавший снег. Под влиянием ветров, собственного веса и оттепелей снежный покров уплотняется, снежинки хотя и сохраняют кристаллическую структуру, но форма их подвергается значительным изменениям. Такой уплотненный (лежалый) снег имеет плотность 0,20- 0,60 г/см3 в зависимости от степени его увлажненности и условий уплотнения.
Лежалый снег в дальнейшем переходит в стадию старого (фирнизированного) снега, полностью утрачивающего свою первичную структуру и формы кристаллов снежинок. Плотность такого снега 0,30-0,70 г/см3. Он состоит из ледяных зерен диаметром 1-5 мм и более. Зернистая структура характерна для снега, подвергавшегося действию оттепелей. Возникновение зернистой структуры происходит под действием частичного таяния и повторного замерзания ледяных кристаллов, которые в ходе этого процесса обволакиваются пленкой талой воды и смерзаются. Этому, в частности, способствуют суточные колебания температуры в период весеннего снеготаяния.
Водоудерживающая способность (влагоемкость) снега. Образовавшаяся при таянии снега вода первоначально содержится в виде пленочной и подвешенной капиллярной влаги, удерживаемой прочно на поверхности частиц снега и в промежутках между ними молекулярными и капиллярными силами.
Относительное количество воды, которое снег способен удерживать в своих порах и капиллярных промежутках вне зоны капиллярного поднятия в виде гигроскопической, пленочной и частично гравитационной воды, представляет собой водоудерживающую способность (влагоемкость) снега, определяемую отношением количества жидкой воды к общему количеству воды, содержащейся в данном объеме снега в жидкой и твердой фазах. Водоудерживающая способность снега может быть выражена в процентах или в долях единицы.
Водоудерживающая способность (влагоемкость) снега зависит от степени его перекристаллизации и плотности. Мелкозернистый метелевый снег обладает большей водоудерживающей способностью, чем крупнозернистый при одной и той же плотности. В процессе таяния мелкозернистый снег быстро перекристаллизовывается и его водоудерживающая способность убывает.
Под влиянием различных явлений погоды в зависимости от степени перекристаллизации и плотности водоудерживающая способность снега по мере его таяния непрерывно меняется.
Влажность снега наряду с максимальной влагоемкостью характеризует его водные свойства. Влажностью снега называется количество воды, содержащейся в нем в рассматриваемый момент времени, выраженное в процентах к общему весу пробы влажного снега.
Химическое название воды
Вода́ (оксид водорода) - химическое вещество в виде прозрачной жидкости, не имеющей цвета (в маломобъёме), запаха и вкуса (при стандартных условиях). Химическая формула: Н2O. В твёрдом состоянииназывается льдом, снегом или инеем, а в газообразном — водяным паром. Около 71 % поверхности Землипокрыто водой (океаны, моря, озёра, реки, льды).
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённыевещества (соли, газы).
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живыхорганизмов, в формировании климата и погоды. Является важнейшим веществом для всех живых существ напланете Земля.
Виды водыВода на Земле может существовать в трёх основных состояниях — жидком, газообразном и твёрдом иприобретать различные формы, которые могут одновременно соседствовать друг с другом: водяной пар иоблака в небе, морская вода и айсберги, ледники и реки на поверхности земли, водоносные слои в земле. Вода способна растворять в себе множество органических и неорганических веществ. Из-за важности воды, «как источника жизни», её нередко подразделяют на типы по различным принципам.
По особенностям происхождения, состава или применения, выделяют, в числе прочего:
Мягкая вода и жёсткая вода — по содержанию катионов кальция и магния
По изотопам молекулы:
Лёгкая вода (по составу почти соответствует обычной)
Тяжёлая вода (дейтериевая)
Сверхтяжёлая вода (тритиевая)
Пресная вода
Дождевая вода
Морская вода
Подземные воды
Минеральная вода
Солоноватая вода (en:Brackish water)
Питьевая вода, Водопроводная вода
Дистиллированная вода и деионизированная вода
Сточные воды
Ливневая вода или поверхностные воды
Апирогенная вода
Мёртвая вода и Живая вода — виды воды из сказок (со сказочными свойствами)
Лёд-девять (вымышленный материал)
Святая вода — особый вид воды согласно религиозным учениям
Поливода
Структурированная вода — термин, применяемый в различных неакадемических теориях.
Талая вода
С формальной точки зрения вода имеет несколько различных корректных химических названий:
Оксид водорода
Гидроксид водорода
Монооксид дигидрогена
Гидроксильная кислота
Оксидан
Дигидромонооксид

Четыре элемента природы, четыре стихии родили на Земле жизнь — это огонь, воздух, земля и вода. Причем вода появилась на нашей планете на несколько миллионов лет, чем та же почва или воздух.
К азалось бы, вода уже изучена человеком, но ученые до сих пор находят самые удивительные факты об этом природном элементе.
азалось бы, вода уже изучена человеком, но ученые до сих пор находят самые удивительные факты об этом природном элементе.
Вода стоит особняком в истории нашей планеты.
Нет природного тела, которое могло бы
сравниться с ней по влиянию на ход основных,
самых грандиозных, геологических процессов.
В.И. Вернадский
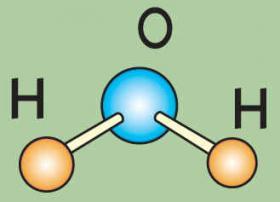
Вода — это самое распространенное неорганическое соединение на земле. И первое исключительное свойство воды в том, что она состоит из соединений атомов водорода и кислорода. Казалось бы, такое соединение, согласно химическим законам, должно быть газообразным. А вода — жидкая!

Так, например, всем известно, что вода существует в природе в трех состояниях: твердом, жидком и в виде пара. Но уже сейчас выделяют более 20 состояний воды, из которых только 14 — это вода в замерзшем состоянии.
Удивительно, но вода — единственное вещество на Земле, плотность которого в твердом состоянии меньше, чем в жидком. Именно поэтому лед не тонет, а водоемы не промерзают до самого дна. Разве что при экстремально холодных температурах.
Еще один факт: вода — универсальный растворитель. По количеству и качеству растворенных в воде элементов и минералов ученые выделяют приблизительно 1330 видов воды: минеральная и талая, дождевая и роса, ледниковая и артезианская…
Вода в природе
В природе вода играет важнейшую роль. При этом она оказывается задействованной в самых разных механизмах и жизненных циклах на земле. Вот лишь несколько фактов, которые наглядно демонстрируют ее значимость для нашей планеты:
Значение круговорота воды в природе просто огромно. Именно этот процесс позволяет животным и растениям получать столь необходимую для их жизни и существования влагу.
М
 оря и океаны, реки и озера — все водоемы играют важнейшую роль в создании климата той или иной местности. А высокая теплоемкость воды обеспечивает комфортный температурный режим на нашей планете.
оря и океаны, реки и озера — все водоемы играют важнейшую роль в создании климата той или иной местности. А высокая теплоемкость воды обеспечивает комфортный температурный режим на нашей планете.Вода играет одну из ключевых ролей в процессе фотосинтеза. Не будь воды, растения не могли бы перерабатывать углекислый газ в кислород, а значит — воздух был бы непригоден для дыхания.

Главный потребитель воды на Земле — это человек. Не случайно все мировые цивилизации формировались и развивались исключительно вблизи водоемов. Значение же воды в жизни человека просто огромное.
Тело человека тоже состоит из воды. В теле новорожденного — до 75% воды, в теле пожилого человека — более 50%. При этом известно, что без воды человек не выживет. Так, когда у нас исчезает хотя бы 2% воды из организма, начинается мучительная жажда. При потере более 12% воды человеку ужу не восстановится без помощи врачей. А потеряв 20% воды из организма, человек умирает.
Вода является для человека исключительно важным источником питания. По статистике один человек за год потребляет до 60 тонн воды только для питания.
Именно вода доставляет к каждой клеточке нашего организма кислород и питательные вещества.
Благодаря наличию воды наш организм может регулировать температуру тела.
Вода также позволяет перерабатывать пищу в энергию, помогает клеткам усваивать питательные вещества. А еще вода выводит шлаки и отходы из нашего тела.
Человек повсеместно использует воду для своих нужд: для питания, в сельском хозяйстве, для различного производства, для выработки электроэнергии. Неудивительно, что борьба за водные ресурсы идет нешуточная. Вот всего лишь несколько фактов:

Более 70% нашей планеты покрыто водой. Но при этом всего 3% всей воды можно отнести к питьевой. И доступ к этому ресурсу с каждым годом становится все труднее. Так, по данным РИА-новости за последние 50 лет на нашей планете произошло более 500 конфликтов, связанных с борьбой за водные ресурсы. Из них более 20 конфликтов переросли в вооруженные столкновения. Это всего лишь одна из цифр, ярко демонстрирующих то, насколько важна роль воды в жизни человека.
Загрязнение воды 
Загрязнением воды называют процесс насыщения водоемов вредными веществами, отходами производства и бытовыми отходами, в результате которого вода теряет большую часть своих функций и становится непригодной для дальнейшего потребления.
Основные источники загрязнения:
Нефтеперерабатывающие предприятия
Тяжелые металлы
Радиоактивные элементы
Ядохимикаты
Стоки городских канализаций и животноводческих ферм.
Ученые давно бьют тревогу, что мировой океан ежегодно получает свыше 13 млн. тонн отходов нефтепродуктов. При этом Тихий океан получает до 9 млн.тонн, а Атлантика — более 30 млн.тонн.
По данным Всемирной Организации Здравоохранения на нашей планете уже не осталось источников, в которых присутствовала бы чистая природная вода. Есть лишь водоемы, загрязненные менее остальных. И это грозит катастрофой нашей цивилизации, так как без воды человечество просто не выживет. А заменить ее нечем.
Что говорят о воде разные источники.
«У тебя, вода, нет ни вкуса, ни цвета, ни запаха,
тебя невозможно описать, тобой наслаждаются,
не ведая, что ты такое… Ты самое большое
богатство в мире». Антуан де Сент-Экзюпери
"Вода - удивительное вещество, без которого невозможно течение жизни" - говориться в нашем учебнике Окружающего мира. Все знают, что вода – жизненно необходима человеку, и что без неё смерть может наступить уже спустя пару дней. Мы настолько привыкли к её присутствию, что не замечаем её, как не замечаем воздух, которым мы дышим. А ведь мы без воды и без воздуха просто не сможем жить! Только представьте, что на 1 час везде пропала вода! Всё – жизнь прекратит своё существование. Вода — основа жизни на нашей планете.
Великая сила воды.
Вода занимает важное место в нашей повседневной жизни. Однако она имеет и высшее значение: ей свойственна целебная сила, о чем неоднократно говорится в Священном Писании. Мы впервые окунаемся в нее в Крещении, когда при принятии этого таинства трижды бываем погружаемы в купель, наполненную святой водой. Святая вода в таинстве Крещения омывает греховные нечистоты человека, обновляет и возрождает его в новую жизнь во Христе.
Понятие о «святой» воде встречается еще в Ветхом Завете: «и возьмет священник святой воды в глиняный сосуд…», а в Новом Завете указано, что в день Крещения Христа на реке Иордан впервые на Земле совершилось «чудесное» освящение воды, чтобы сделать ее источником священного обновления для человека. Церковь ежегодно продолжает освящать воду в день Крещения, что «возвращает водной стихии чистоту и святость, низводит на воду силой молитвы и слова благословение и благодать Пресвятого и Животворящего Духа».
Вода лечит.
Целебность святой воды насыщенна надеждами, которые на неё возлагают верующие люди. Известно много случаев исцеления больных, использующих такую воду. Но, так уж устроен человек, ему сложно просто верить, необходимо проверить всё опытным путём. Уникальное исследование крещенской воды, проведённое в Троице-Сергиевой Лавре, показало, крещенская вода имеет отличные от простой воды электромагнитные показатели, схожие с теми, которые излучает организм здорового и полного сил человека. Научно подтверждено, что ежегодно 18-19 января вода приобретает удивительные свойства.2 Зафиксированы улучшения и увеличение в десятки раз биополя человека, а так же улучшение его физических и энергетических показателей при использовании крещенской воды в качестве питьевой и наружно.2 Набранная в это время вода долго сохраняет свои лечебные свойства.
Целебные свойства крещенской воды некоторые ученые объясняют особенностями магнитного поля Земли. В этот день оно отклоняется от нормы и вся вода на планете омагничивается. С чем связаны эти изменения, изучено пока не до конца.
Профессор Антон Бельский, российский физик-экспериментатор, как-то в ночь на 19 января взял в ближайшем пруду пробы воды в полиэтиленовые бутылки. Они стояли у него в лаборатории много лет. Вода в них оставалась прозрачной, без запаха и осадка.
На одной из научных конференций он рассказал об этом «эксперименте» знакомому профессору из НИИ ядерной физики при МГУ, занимавшемуся исследованием нейтронных потоков из космоса и от Земли. Тот, пообещал посмотреть свои экспериментальные данные за последние годы. Вскоре А. Бельский получил по электронной почте весьма любопытную информацию.
По его данным, перед 19 января целый ряд лет регистрировались интенсивные всплески потока нейтронов, превышающие фоновые уровни в 100-200 раз! А стерилизующая роль интенсивных нейтронных потоков общеизвестна.3
«В глуши лесной, в глуши зеленой…
Бьет из камней родник студеный…» (И. А. Бунин «Родник»)
Так же жизненная сила присуща источникам, которые находятся в природе. Называть их принято «святыми» за их целебные свойства. На территории России большое количество таких источников. Почитаться святыми могут родники, колодцы и даже целые озёра.
Доступ к святым источникам открыт постоянно. Здесь разрешается набирать воду, обливаться, купаться, поэтому часто возле источников специально устраивают купальни. Окунаться в воду следует с молитвой.
Сотни людей с младенцами, старики приезжают на святые источники из далёких мест.
В моей семье тоже существует светлая традиция – поездки на Святые источники, где мы обязательно окунаемся в купель и набираем святую воду. В этот день всегда хорошее, доброе настроение.
Необычные свойства воды.
В Библии сказано, что Воду на Земле Бог создал до света, до создания тверди земной, даже до времени. Воду Бог создал в первый день Творения. Недаром на протяжении тысячелетий вода символизировала саму сущность жизни. Еще на заре цивилизации люди осознавали: вода - нечто живое, имеющее душу, способное развиваться и реагировать на окружающий мир.
Сегодня опытным путём доказано, что вода способна воспринимать, хранить и передавать информацию. Это свойство воды было названо «структурной памятью». Вода способна хранить информацию обо всех веществах, которые были в ней растворены – причём, хранит даже тогда, когда все примеси из неё удалены.
Структура воды – это организация её молекул.
На уроке окружающего мира мы узнали, что вода состоит из молекул. Изучая этот вопрос самостоятельно, мы нашли интересную информацию, о том что молекулы воды (рисунок 1), объединяясь между собой, образуют кластерные ячейки (рисунок 2 и 3), каждая из которых представляет собой как бы миниатюрный компьютер.


 Рисунок 1.Молекула воды Рисунок 2. Кластер воды Рисунок 3.
Рисунок 1.Молекула воды Рисунок 2. Кластер воды Рисунок 3.
Кластеры и являются своеобразными ячейками памяти, на которых вода хранит воспринимаемую информацию.1
Под воздействием внешних факторов, молекулы воды перестраиваются. Особенно наглядно изменчивость воды продемонстрировали японские исследователи. Подвергая воду различным воздействиям, они замораживали ее, фотографировали и сравнивали изменения.1
Оказалось, что молекулярную структуру воды меняют вибрации человеческой энергии, мыслей, слов, идей и звуков (рисунок 4, 5, 6)1
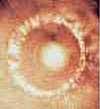


Рисунок 4 Рисунок 5 Рисунок 6
Кристалл дистиллированной Антарктический лёд Ключевая вода
воды, не подвергнутый
никакому воздействию.
В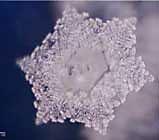
 лаборатории доктора Масару Эмото провели много экспериментов с целью найти то слово, которое сильнее всего очищает воду, и в результате обнаружили, что это не одно слово, а сочетание двух слов: "Любовь и Благодарность"(рисунок 7,8)1
лаборатории доктора Масару Эмото провели много экспериментов с целью найти то слово, которое сильнее всего очищает воду, и в результате обнаружили, что это не одно слово, а сочетание двух слов: "Любовь и Благодарность"(рисунок 7,8)1
Рисунок 7. Рисунок 8.
Слова любовь и Слова любовь и
благодарность благодарность
на английском. на японском.
Структура воды делает ее настоящим чудом природы и причиной, по которой на Земле, единственной из всех известных нам планет, есть жизнь в той форме, в которой она известна нам.
Вспомните об этом в следующий раз, когда возьмете в руку стакан с водой.
В заключение... Вода - самое распространенное среди неорганических веществ на нашей планете. Она содержится практически везде: на земной поверхности и в её недрах, в мантии и в горных породах, в высоких слоях атмосферы и даже в космосе. Химические свойства воды определены её химическим составом. Её относят к группе химически активных веществ. Со многими веществами вода вступает в химические реакции. 71 % поверхности Земли покрывает вода.
Список источников:
1. Загадки воды//www.hram-feodosy.kiev.ua
2. Крещенская вода: научные доказательства чудесных свойств Крещенской воды//pravsobor.kz
3. О Святой воде. http://daranig.kz/ru/voda.php
4. Священники о святой воде. http://www.celitelstvo.su/news/uchjonye_i_svjashhenniki_o_svjatoj_vode/2010-01-18-106
5. "Закон Божий руководство для семьи и школы" составил протоиерей Серафим Слободской.
6. . Эмото Масару «Любовь и вода» – М.: София, 2008
7.https://ru.wikipedia.org/wiki/Вода#.D0.91.D0.B8.D0.BE.D0.BB.D0.BE.D0.B3.D0.B8.D1.87.D0.B5.D1.81.D0.BA.D0.B0.D1.8F_.D1.80.D0.BE.D0.BB.D1.8C_.D0.B2.D0.BE.D0.B4.D1.8B
8.https://ru.wikipedia.org/wiki/Вода#.D0.91.D0.B8.D0.BE.D0.BB.D0.BE.D0.B3.D0.B8.D1.87.D0.B5.D1.81.D0.BA.D0.B0.D1.8F_.D1.80.D0.BE.D0.BB.D1.8C_.D0.B2.D0.BE.D0.B4.D1.8B
9. https://ru.wikipedia.org/wiki/Вода
10. http://abratsev.ru/hydrosphere/phisprop1.html
11. https://www.syl.ru/article/185501/new_voda---osnova-jizni-fizicheskie-i-himicheskie-svoystva-vodyi
12. http://dic.academic.ru/dic.nsf/ruwiki/264
3
23

 Получите свидетельство
Получите свидетельство Вход
Вход












 Исследовательская работа по химии и физике "Вода" (508.5 KB)
Исследовательская работа по химии и физике "Вода" (508.5 KB)
 0
0 1026
1026 17
17 Нравится
0
Нравится
0




