
ТЕМА УРОКА: «Ионные уравнения реакций»

ЦЕЛЬ: - научиться составлять полные и сокращенные ионные уравнения
ЗАДАЧИ:
- Закрепить умения составлять молекулярные уравнения реакций;
- Познакомиться с ионными уравнения реакций и научиться их составлять;
- Познакомиться с реакциями нейтрализации .

ОТВЕТЬТЕ НА СЛЕДУЮЩИЕ ВОПРОСЫ: 1) Что такое электролитическая диссоциация? 2) Что такое ионы? 3) Какие ионы образуются при диссоциация кислот, оснований и солей?

1) Цинк + серная кислота сульфат цинка + водород
Zn + H 2 SO 4 ZnSO 4 + H 2
Zn 0 + 2 H + + SO 4 2- Zn 2+ + SO 4 2- + H 2 0
Zn 0 + 2 H + Zn 2+ + H 2 0
2) Железо + сульфат меди( II ) сульфат железа ( II ) + медь
Fe + CuSO 4 FeSO 4 + Cu
Fe 0 + Cu 2+ + SO 4 2- Fe 2+ + SO 4 2- + Cu 0
Fe 0 + Cu 2+ + SO 4 2- Fe 2+ + SO 4 2- + Cu 0
Fe 0 + Cu 2+ Fe 2+ + Cu 0

3) соляная кислота + марганец
2 HCl + Mn MnCl 2 + H 2
2H + + 2Cl - + Mn 0 Mn 2+ + 2Cl - + H 2 0
2H + + 2Cl - + Mn 0 Mn 2+ + 2Cl - + H 2 0
4) хлорид железа ( II ) + цинк
FeCl 2 + Zn ZnCl 2 + Fe
Fe 2+ + 2Cl - + Zn 0 Zn 2+ + 2Cl - + Fe 0
Fe 2+ + Zn 0 Zn 2+ + Fe 0
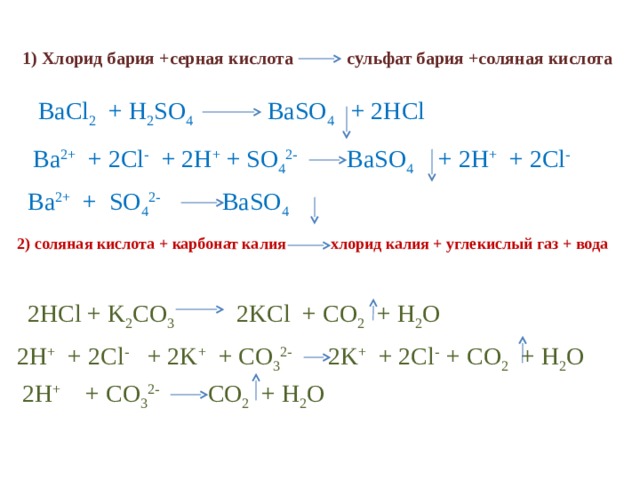
1) Хлорид бария +серная кислота сульфат бария +соляная кислота
BaCl 2 + H 2 SO 4 BaSO 4 + 2HCl
Ba 2+ + 2Cl - + 2H + + SO 4 2- BaSO 4 + 2H + + 2Cl -
Ba 2+ + SO 4 2- BaSO 4
2) соляная кислота + карбонат калия хлорид калия + углекислый газ + вода
2HCl + K 2 CO 3 2KCl + CO 2 + H 2 O
2HCl + K 2 CO 3 2KCl + CO 2 + H 2 O
2H + + 2Cl - + 2K + + CO 3 2- 2K + + 2Cl - + CO 2 + H 2 O
2H + + 2Cl - + 2K + + CO 3 2- 2K + + 2Cl - + CO 2 + H 2 O
2H + + CO 3 2- CO 2 + H 2 O
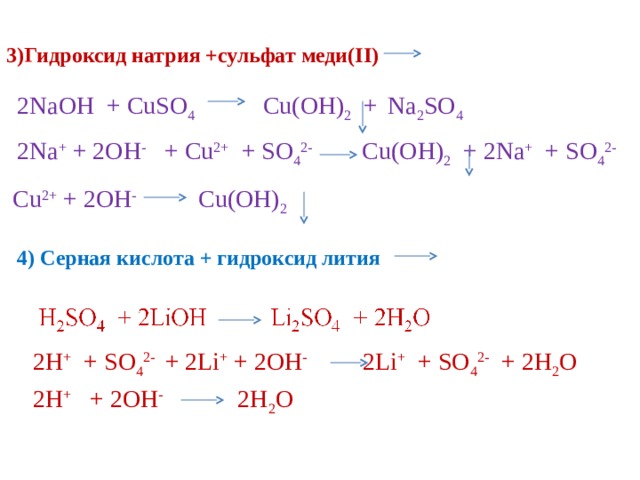
3)Гидроксид натрия +сульфат меди( II )
2NaOH + CuSO 4 Cu(OH) 2 + Na 2 SO 4
2Na + + 2OH - + Cu 2+ + SO 4 2- Cu(OH) 2 + 2Na + + SO 4 2-
Cu 2+ + 2OH - Cu(OH) 2
4) Серная кислота + гидроксид лития
H 2 SO 4 + 2LiOH Li 2 SO 4 + 2H 2 O
2H + + SO 4 2- + 2Li + + 2OH - 2Li + + SO 4 2- + 2H 2 O
2H + + SO 4 2- + 2Li + + 2OH - 2Li + + SO 4 2- + 2H 2 O
2H + + 2OH - 2H 2 O

Закрепление материала: §37, №5(а,г) самостоятельно составьте уравнения реакция, о которых говорится в данном задании.
Домашнее задание:§37, №5(б,д)

 Получите свидетельство
Получите свидетельство Вход
Вход











 Ионные химические реакции (368 KB)
Ионные химические реакции (368 KB)
 0
0 529
529 4
4 Нравится
0
Нравится
0



