ПРАКТИЧЕСКАЯ РАБОТА № 1
Тема: Правила техники безопасности при работе в кабинете химии. Приемы обращения с лабораторным штативом и спиртовкой. Изучение строения пламени.
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: учебник химии для 8 класса, лабораторный штатив, пробирка, химический стаканчик, фарфоровая чашка, спиртовка, спички, держатель для пробирок.
Ход работы:
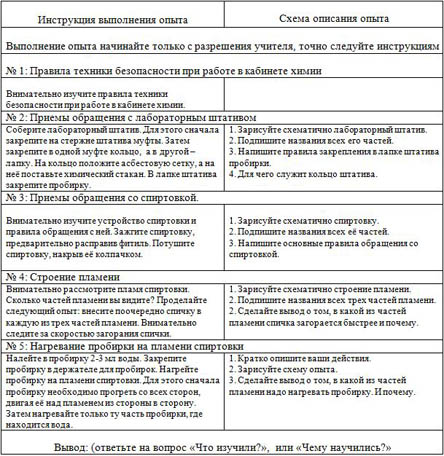
|
Инструкция выполнения опыта |
Схема описания опыта |
|
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям |
|
№ 1: Правила техники безопасности при работе в кабинете химии |
|
Внимательно изучите правила техники безопасности при работе в кабинете химии. |
|
| № 2: Приемы обращения с лабораторным штативом |
| Соберите лабораторный штатив. Для этого сначала закрепите на стержне штатива муфты. Затем закрепите в одной муфте кольцо, а в другой – лапку. На кольцо положите асбестовую сетку, а на неё поставьте химический стакан. В лапке штатива закрепите пробирку. | 1. Зарисуйте схематично лабораторный штатив. 2. Подпишите названия всех его частей. 3. Напишите правила закрепления в лапке штатива пробирки. 4. Для чего служит кольцо штатива. |
| № 3: Приемы обращения со спиртовкой. |
|
Внимательно изучите устройство спиртовки и правила обращения с ней. Зажгите спиртовку, предварительно расправив фитиль. Потушите спиртовку, накрыв её колпачком. |
1. Зарисуйте схематично спиртовку. 2. Подпишите названия всех её частей. 3. Напишите основные правила обращения со спиртовкой.
|
| № 4: Строение пламени |
| Внимательно рассмотрите пламя спиртовки. Сколько частей пламени вы видите? Проделайте следующий опыт: внесите поочередно спичку в каждую из трех частей пламени. Внимательно следите за скоростью загорания спички. | 1. Зарисуйте схематично строение пламени. 2. Подпишите названия всех трех частей пламени. 2. Сделайте вывод о том, в какой из частей пламени спичка загорается быстрее и почему. |
| № 5: Нагревание пробирки на пламени спиртовки |
| Налейте в пробирку 2-3 мл воды. Закрепите пробирку в держателе для пробирок. Нагрейте пробирку на пламени спиртовки. Для этого сначала пробирку необходимо прогреть со всех сторон, двигая её над пламенем из стороны в сторону. Затем нагревайте только ту часть пробирки, где находится вода. | 1. Кратко опишите ваши действия. 2. Зарисуйте схему опыта. 3. Сделайте вывод о том, в какой из частей пламени надо нагревать пробирку. И почему. |
|
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» |
ПРАКТИЧЕСКАЯ РАБОТА № 2
Тема: очистка загрязненной поваренной соли
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: смесь поваренной соли, речного песка и древесных опилок, спиртовка, спички, держатель для пробирок, пробирка, воронка, штатив для пробирок, предметное стекло, химический стакан, стеклянная палочка
Ход работы:
|
Инструкция выполнения опыта |
Схема описания опыта |
|
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям |
|
Опыт 1: Растворение загрязненной поваренной соли |
| В химический стакан со смесью песка, соли и опилок налейте немного воды и перемешайте стеклянной палочкой до полного растворения соли.
| 1. Кратко опишите ваши действия. 2. Сделайте вывод о том, что произошло со смесью. |
|
Опыт 2: Фильтрование раствора загрязненной поваренной соли |
| Сложите фильтр и вставьте его в воронку. Воронку вставьте в пустую пробирку. Осторожно налейте смесь в воронку, но не до краев. Наблюдайте за процессом фильтрования. | 1. Кратко опишите ваши действия. 2. Зарисуйте схему опыта. 2. Сделайте вывод о том, что представляет из себя фильтрат, что осталось на фильтре. |
|
Опыт 3: Выпаривание раствора поваренной соли |
| Закрепите предметное стекло в держателе для пробирок. Нанесите на него несколько капель очищенного раствора поваренной соли. Зажгите спиртовку и выпарите воду. Сначала прогрейте все стекло, а затем нагревайте только в том месте, где находится раствор. Наблюдайте за процессом выпаривания. | 1. Кратко опишите ваши действия. 2. Зарисуйте схему опыта. 3. Сделайте вывод о том, что осталось на предметном стекле после выпаривания. |
|
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» |
ПРАКТИЧЕСКАЯ РАБОТА № 3
Тема: получение, собирание и распознавание кислорода
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, прибор для получения газов, вода, гидроперит, оксид марганца (IV), спички, деревянная лучинка.
Ход работы:
|
Инструкция выполнения опыта |
Схема описания опыта |
|
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям |
|
Опыт 1: получение кислорода |
| В прибор для получения газов поместите таблетку гидроперита и добавьте 1-2 мл воды. Затем добавьте немного оксида марганца (IV). Закройте прибор пробкой с газоотводной трубкой. Конец трубки опустите в пустую пробирку. Наблюдайте за происходящей реакцией. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирке во время реакции. 3. Составьте уравнение химической реакций: Н2О2 = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как можно получить кислород и какую роль в этом опыте сыграл оксид марганца (IV), а также о том как нужно собирать кислород. |
|
Опыт 2: свойства кислорода |
| В пробирку с собранным кислородом опустите тлеющую лучинку (для этого сначала зажгите лучинку и дайте ей немного прогореть, а затем потушите так, чтобы на конце её образовался уголек). Наблюдайте за происходящим явлением. Будьте осторожны при обращении с огнем. | 1. Кратко опишите ваши действия (что к чему добавили, что делали) 2. Опишите ваши наблюдения, что произошло с тлеющей лучинкой в пробирке с кислородом. 3. Составьте уравнение химической реакций: С + О2 = 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, почему тлеющая лучинка загорелась. |
|
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» |
ПРАКТИЧЕСКАЯ РАБОТА № 4
Тема: получение, собирание и распознавание водорода
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, прибор для получения газов, цинк, соляная кислота, спички.
Ход работы:
|
Инструкция выполнения опыта |
Схема описания опыта |
|
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям |
|
Опыт 1: получение водорода |
| В прибор для получения газов поместите несколько гранул цинка и добавьте 1-2 мл соляной кислоты. Не допускайте попадания кислоты на руки и одежду! Закройте прибор пробкой с газоотводной трубкой. Конец трубки опустите в пустую пробирку. Наблюдайте за происходящей реакцией. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирке во время реакции. 3. Составьте уравнение химической реакций: Zn + НCL= Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как можно получить и собрать водород. |
|
Опыт 2: свойства водорода |
| Пробирку с собранным водородом закройте пальцем, переверните, зажгите спичку и поднесите к отверстию пробирки, одновременно убрав палец. Наблюдайте за происходящим явлением. Будьте осторожны при обращении с огнем. | 1. Кратко опишите ваши действия (что к чему добавили, что делали) 2. Опишите ваши наблюдения, что произошло с газом? 3. Составьте уравнение химической реакций: Н2 + О2 = 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как сгорает водород. |
|
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» |
ПРАКТИЧЕСКАЯ РАБОТА № 5
Тема: приготовление раствора с заданной массовой долей растворенного вещества.
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: весы учебные с набором гирь, химический стакан, поваренная соль, мерный цилиндр, стеклянная палочка, вода.
Ход работы:
|
Инструкция выполнения опыта |
Схема описания опыта |
|
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям |
|
№ 1: решение задачи |
|
Приготовьте 50 мл 2 % раствора поваренной соли. Решите задачу, найдите массу соли и массу воды.
|
Запишите решение задачи в тетрадь. |
|
№ 2: взвешивание соли |
|
Уравновесьте чашки весов. Для этого подкручивайте винтики сбоку то с одной стороны, то с другой. На одну чашку весов положите гирю, соответствующую найденной массе соли. На другую постепенно насыпайте соль, добиваясь равновесия. Взвешенную соль высыпьте в пустой химический стакан.
|
1. Кратко опишите ваши действия (что делали) 2. Зарисуйте схему опыта. 5. Сделайте вывод о том, как нужно правильно взвешивать. |
|
№ 3: измерение объёма воды |
|
|
В мерный цилиндр налейте полученное при расчетах количество воды. Уровень воды в цилиндре измеряют по нижнему краю мениска. |
1. Кратко опишите ваши действия (что делали) 2. Зарисуйте схему опыта. 5. Сделайте вывод о том, как нужно правильно измерять объём жидкости. |
|
№ 4: приготовление заданного раствора поваренной соли |
|
В химический стакан с солью вылейте воду, перемешайте стеклянной палочкой до полного растворения соли. |
1. Кратко опишите ваши действия (что делали) 2. Зарисуйте схему опыта. 5. Сделайте вывод о том, как правильно приготовить раствор с заданной процентной концентрацией. |
|
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» |
ПРАКТИЧЕСКАЯ РАБОТА № 6
Тема: решение экспериментальных задач
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, держатель для пробирок, спиртовка, спички, соляная кислота, гидроксид калия, оксид меди (II)
Ход работы:
|
Инструкция выполнения опыта |
Схема описания опыта |
|
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям |
|
Задача: получите гидроксид меди (II) из оксида меди (II)
|
|
Опыт 1: получение хлорида меди (II) из оксида меди (II) |
| В пробирку поместите немного порошка оксида меди (II) и добавьте 1-2 мл соляной кислоты. Не допускайте попадания кислоты на руки и одежду! Закрепите пробирку в держателе и осторожно нагрейте на пламени спиртовки. Наблюдайте за происходящей реакцией. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирке во время реакции? Как изменился цвет раствора? 3. Составьте уравнение химической реакций: CuO + НCL= Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как можно получить хлорид меди (II) из оксида меди (II). |
|
Опыт 2: получение гидроксида меди (II) из хлорида меди (II) |
| В пробирку с полученным в первом опыте хлоридом меди (II) добавьте раствор гидроксида калия. Наблюдайте за происходящей реакцией. | 1. Кратко опишите ваши действия (что к чему добавили, что делали) 2. Опишите ваши наблюдения, что произошло с содержимым пробирки? 3. Составьте уравнение химической реакций: CuCL2 + КОН = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, почему изменился цвет раствора. |
|
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» |
ПРАКТИЧЕСКАЯ РАБОТА № 7
Тема: химические свойства соляной кислоты
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, соляная кислота, магний, медь, карбонат кальция, хлорид натрия, нитрат серебра (I)
Ход работы:
|
Инструкция выполнения опыта |
Схема описания опыта |
|
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям |
|
Опыт 1: взаимодействие соляной кислоты с металлами |
| В две пробирки поместите немного порошка магния и кусочек медной проволоки, осторожно добавьте 1-2 мл соляной кислоты. Наблюдайте за происходящей реакцией. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирках во время реакции. 3. Составьте уравнения химических реакций: Mg + НCL= Cu+ НCL= Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как соляная кислота взаимодействует с различными металлами. |
|
Опыт 2: взаимодействие соляной кислоты с карбонатами |
| В пробирку поместите несколько кусочков мрамора и добавьте 1-2 мл раствора соляной кислоты. Не допускайте попадания кислоты на руки и одежду! Наблюдайте за происходящими реакциями. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирках во время реакции. 3. Составьте уравнение химической реакций: СаСО3 + HCL = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Как можно объяснить выделение газа? |
|
Опыт 3: распознавание соляной кислоты и ее солей |
| В одну пробирку налейте немного раствора соляной кислоты в другую раствор хлорида натрия. В обе пробирки добавьте по нескольку капель раствора нитрата серебра (I). Наблюдайте за происходящими реакциями. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирках во время реакции. 3. Составьте уравнения химических реакций: AgNO3 + НCL= NaCL+ AgNO3 = 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как можно отличить соляную кислоту от других кислот? |
|
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» |
ПРАКТИЧЕСКАЯ РАБОТА № 1
Тема: Решение экспериментальных задач по теме "Электролитическая диссоциация"
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, индикатор лакмус, растворы солей - хлорид калия, карбонат натрия, хлорид алюминия.
Ход работы:
|
Инструкция выполнения опыта |
Схема описания опыта |
|
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям |
|
Опыт 1: распознавание растворов солей |
|
В трёх пробирках под номерами даны растворы солей - хлорид калия, карбонат натрия и хлорид алюминия. Добавьте в каждую пробирку по 1-2 капли индикатора лакмуса. Наблюдайте за изменением цвета в каждой пробирке. |
1. Кратко опишите ваши действия (что к чему добавили). 2. Опишите ваши наблюдения. Как изменился цвет в каждой из пробирок. 3. Составьте уравнения реакций гидролиза каждой соли по 1 ступени. Какая среда раствора каждой соли? Каково значение pH каждого раствора соли? 4. Сделайте вывод о том, какой раствор соли находился в какой пробирке. |
|
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» |
ПРАКТИЧЕСКАЯ РАБОТА № 2
Тема: Решение экспериментальных задач по теме " Кислород и сера "
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, индикатор лакмус, растворы солей - хлорид калия, карбонат натрия, хлорид алюминия.
Ход работы:
|
Инструкция выполнения опыта |
Схема описания опыта |
| Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям |
| Опыт 1: распознавание растворов солей |
|
В трёх пробирках под номерами даны растворы солей - хлорид калия, карбонат натрия и хлорид алюминия. Добавьте в каждую пробирку по 1-2 капли индикатора лакмуса. Наблюдайте за изменением цвета в каждой пробирке. |
1. Кратко опишите ваши действия (что к чему добавили). 2. Опишите ваши наблюдения. Как изменился цвет в каждой из пробирок. 3. Составьте уравнения реакций гидролиза каждой соли по 1 ступени. Какая среда раствора каждой соли? Каково значение pH каждого раствора соли? 4. Сделайте вывод о том, какой раствор соли находился в какой пробирке. |
|
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» |
ПРАКТИЧЕСКАЯ РАБОТА № 3
Тема: «Свойства водного раствора аммиака»
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, индикаторы лакмус и фенолфталеин, сульфат меди(II), соляная кислота.
Ход работы:
|
Инструкция выполнения опыта |
Схема описания опыта |
|
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям |
|
Опыт 1: отношение к индикаторам |
|
В пробирку с водным раствором аммиака добавьте 1-2 капли индикатора лакмуса. Наблюдайте за изменением цвета в пробирке. |
1. Кратко опишите ваши действия (что к чему добавили). 2. Опишите ваши наблюдения. Как изменился цвет в пробирке. 3.О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы?
|
| Опыт 2: взаимодействие с кислотами |
| В пробирку с водным раствором аммиака добавьте 1-2 капли индикатора фенолфталеина. Наблюдайте за изменением цвета в пробирке. Затем добавьте 1-2 мл раствора соляной кислоты. Не допускайте попадания кислоты на руки и одежду! Наблюдайте за происходящими реакциями. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирке во время реакции. 3. Составьте уравнение химической реакций: NH4 ОН + HCL = 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, что происходит при действии на водный раствор аммиака кислоты. |
| Опыт 3: взаимодействие с солями |
| В пробирку с раствором сульфата меди(II) добавьте водный раствор аммиака. Наблюдайте за изменением цвета в пробирке. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирке во время реакции. 3. Составьте уравнение химической реакций: NH4 ОН +CuSO4 = 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, что происходит при действии на растворы солей водного раствора аммиака. |
|
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» |
ПРАКТИЧЕСКАЯ РАБОТА № 4
Тема: Определение минеральных удобрений
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, спиртовка, спички, держатель для пробирок, растворы гидроксида натрия и нитрата серебра (I), образцы минеральных удобрений – хлорид аммония, суперфосфат, хлорид калия.
Ход работы:
|
Инструкция выполнения опыта |
Схема описания опыта |
|
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям |
|
Задание : В трех химических стаканчиках под номерами даны образцы минеральных удобрений – хлорид аммония, суперфосфат, хлорид калия. Определите, в каком стаканчике находится каждое из указанных удобрений. |
| Опыт 1: определение цвета и внешнего вида образцов минеральных удобрений |
| Внимательно рассмотрите образцы минеральных удобрений. Пользуясь таблицей учебника (стр.68) | 1. Кратко опишите ваши действия. 2. Пользуясь таблицей учебника (стр.68) опишите внешний вид образцов минеральных удобрений. |
| Опыт 2: растворимость в воде образцов минеральных удобрений |
| В пробирки с водой добавьте немного образцов минеральных удобрений. Перемешайте. Наблюдайте за происходящими явлениями. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, оцените растворимость в воде образцов минеральных удобрений. 3. Зарисуйте схему опыта. |
| Опыт 3: взаимодействие с раствором щелочи при нагревании |
| В пробирки с растворами образцов минеральных удобрений добавьте раствор гидроксида натрия. Закрепите пробирки в держателе и нагрейте на пламени спиртовки. Наблюдайте за происходящими явлениями. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирках во время реакции. В какой из пробирок ощущается запах аммиака? 3. Составьте уравнения химической реакции: NH4 CL +NaOH = 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, что происходит с образцами минеральных удобрений при взаимодействии с раствором щелочи при нагревании. |
| Опыт 4: взаимодействие с раствором нитрата серебра (I) |
| В пробирку с раствором минерального удобрения добавьте раствор нитрата серебра (I). | 1. Кратко опишите ваши действия. 2. Опишите ваши наблюдения, отметьте цвет осадка. 3. Составьте уравнения химической реакции: AgNO3 + Cа(Н2 РО4)2 = 4. Зарисуйте схему опыта. 5. Сделайте вывод. |
|
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» |
ПРАКТИЧЕСКАЯ РАБОТА № 5
Тема: получение оксида углерода (IV) и изучение его свойств
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, прибор для получения газов, соляная кислота, мрамор, известковая вода, индикатор лакмус, вода.
Ход работы:
|
Инструкция выполнения опыта |
Схема описания опыта |
|
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям |
|
Опыт 1: получение оксида углерода (IV) |
| В прибор для получения газов поместите несколько кусочков мрамора и добавьте 1-2 мл раствора соляной кислоты. Не допускайте попадания кислоты на руки и одежду! Закройте прибор пробкой с газоотводной трубкой. Конец трубки опустите в пробирку с водой. Наблюдайте за происходящими реакциями. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирках во время реакции. 3. Составьте уравнение химической реакций: СаСО3 + HCL = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как можно получить оксид углерода (IV). |
|
Опыт 2: взаимодействие оксида углерода (IV) с водой |
| В пробирку с водой, через которую пропускали оксида углерода (IV) добавьте несколько капель раствора лакмуса. Отметьте изменение окраски индикатора. | 1. Кратко опишите ваши действия (что к чему добавили, что делали) 2. Опишите ваши наблюдения, как изменился цвет раствора в пробирке. 3. Составьте уравнение химической реакций: СО2 + H2О = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, почему изменился цвет индикатора, какое вещество образовалось при пропускании оксида углерода (IV) через воду. |
|
Опыт 3: взаимодействие оксида углерода (IV) с известковой водой |
| Конец газоотводной трубки опустите в пробирку с известковой водой и пропускайте через неё оксид углерода (IV). Наблюдайте за происходящими изменениями в пробирке и известковой водой. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирках во время реакции, что получилось после окончания реакции. 3. Составьте уравнения химических реакций: СО2 + Са(ОН)2 = СаСО3 + СО2 + Н2О = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, почему при пропускании оксида углерода (IV) через раствор известковой воды сначала происходит помутнение, а затем раствор становится прозрачным.
|
|
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» |
ПРАКТИЧЕСКАЯ РАБОТА № 6
Тема: Решение экспериментальных задач по теме «Элементы IА—IIIА-групп ПСХЭ»
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, держатель для пробирок, спиртовка, спички, соляная кислота, гидроксид калия, оксид меди (II)
Ход работы:
|
Инструкция выполнения опыта |
Схема описания опыта |
|
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям |
|
   Задача: осуществите цепочку превращений СаО СаCL2 Са(ОН)2 СаSO4 Задача: осуществите цепочку превращений СаО СаCL2 Са(ОН)2 СаSO4
|
|
Опыт 1: получение хлорида кальция из оксида кальция |
| В пробирку поместите немного порошка оксида кальция и добавьте 1-2 мл соляной кислоты. Не допускайте попадания кислоты на руки и одежду! Наблюдайте за происходящей реакцией. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирке во время реакции? 3. Составьте уравнение химической реакций: CаО + НCL= Расставьте коэффициенты. 4. Зарисуйте схему опыта. |
|
Опыт 2: получение гидроксида кальция из оксида кальция |
| В пробирку с полученным в первом опыте хлоридом кальция добавьте раствор гидроксида калия. Наблюдайте за происходящей реакцией. | 1. Кратко опишите ваши действия (что к чему добавили, что делали) 2. Опишите ваши наблюдения, что произошло с содержимым пробирки? 3. Составьте уравнение химической реакций: CаCL2 + КОН = Расставьте коэффициенты. 4. Зарисуйте схему опыта. |
| Опыт 3: получение сульфата кальция из гидроксида кальция |
| В пробирку с полученным гидроксидом кальция добавьте 1-2 мл серной кислоты. Не допускайте попадания кислоты на руки и одежду! Наблюдайте за происходящей реакцией. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирке во время реакции? 3. Составьте уравнение химической реакций: Cа(ОН)2 + Н2SO4= Расставьте коэффициенты. 4. Зарисуйте схему опыта. |
|
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» |
ПРАКТИЧЕСКАЯ РАБОТА № 7
Тема: получение гидроксидов железа и изучение их свойств
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, раствор сульфата железа (II), раствор хлорида железа (III), соляная кислота, гидроксид натрия, перекись водорода.
Ход работы:
| Инструкция выполнения опыта | Схема описания опыта |
| Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям |
| Опыт 1: получение гидроксида железа (II) |
| Налейте в пробирку 2-3 мл раствора сульфата железа (II) и добавьте немного раствора гидроксида натрия. Наблюдайте за происходящими изменениями. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, отметьте цвет получившегося осадка. 3. Составьте уравнение химической реакций: FeSO4 + NaOH = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как можно получить гидроксид железа (II) . |
| Опыт 2: свойства гидроксида железа (II) |
| Полученный в первом опыте гидроксид железа (II) разделите на две пробирки. В одну пробирку добавьте раствор соляной кислоты, в другую – раствор перекиси водорода. | 1. Кратко опишите ваши действия (что к чему добавили, что делали) 2. Опишите ваши наблюдения, что стало с осадком в первой пробирке, как изменился цвет осадка во второй пробирке. 3. Составьте уравнения химических реакций: Fe(OH)2 + HCL = Fe(OH)2 + H2O2 = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, что происходит с гидроксидом железа (II) при взаимодействии с соляной кислотой и перекисью водорода. |
| Опыт 3: получение гидроксида железа (III) |
| Налейте в пробирку 2-3 мл раствора хлорида железа (III) и добавьте немного раствора гидроксида натрия. Наблюдайте за происходящими изменениями. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, отметьте цвет получившегося осадка. 3. Составьте уравнение химической реакций: FeCL3 + NaOH = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как можно получить гидроксид железа (III). |
| Опыт 4: свойства гидроксида железа (III) |
| К полученному в предыдущем опыте гидроксиду железа (III) добавьте немного раствора серной кислоты. Не допускайте попадания кислоты на руки и одежду! Наблюдайте за происходящими изменениями. | 1. Кратко опишите ваши действия. 2. Опишите ваши наблюдения, что произошло с осадком. 3. Составьте уравнение химической реакций: Fe(OH)3 + H2SO4 = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, что происходит с гидрок-сидом железа (III) при взаимодействии с серной кислотой. |
| Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» |

 Получите свидетельство
Получите свидетельство Вход
Вход












 Инструкционные карты практических работ по химии (44.9 КB)
Инструкционные карты практических работ по химии (44.9 КB)
 0
0 3022
3022 448
448 Нравится
0
Нравится
0








