Тимофеева Галина Владимировна,
учитель химии высшей категории
МБОУ ООШ №15
г. Ельца Липецкой области
УРОК НА ТЕМУ:
«Гидролиз в неорганической и органической химии»
11 класс
«Опыт – единственно верный путь спрашивать природу и слышать ответ в ее лаборатории»
Д.И.Менделеев
ЦЕЛИ:
Обучающая: обобщить понятие гидролиз;
научить экспериментально подтверждать результатами гидролиза солей – сущность гидролиза как физико-химического процесса;
научить записывать краткие и полные ионные, а также молекулярные уравнения реакций по 1 стадии;
объяснять изменения среды и образование кислых и основных солей.
Познавательная: охарактеризовать практическое значение гидролиза.
Развивающая: развивать у обучающихся, соблюдая ПТБ, умения экспериментирования, сопоставления и сравнения результатов, на основе чего делать правильные выводы.
Воспитывающая: воспитывать у обучающихся чувство распределения учебного времени, правильное отношение к реактивам, соблюдение ПТБ.
Методическая: методика решения проблем восприятия на уроках химии на основе практических исследований.
ОБОРУДОВАНИЕ: на столах учащихся: методичка, схема-конспект, растворы: NaCl, AlCl3, K2CO3, раствор лакмуса;
на демонстрационном столе: таблицы по ТБ, таблицы к уроку, растворы: H2O (дист.), NaOH, HCl, NaCl, AlCl3, K2CO3, раствор лакмуса.
ХОД УРОКА.
На сегодняшнем уроке у нас с вами семинар-практикум на тему: «Гидролиз в неорганической и органической химии».
На уроке мы обобщим знания о гидролизе на примере органических и органических веществ; рассмотрим сущность гидролиза – сопоставляя данные лабораторных исследований; сделаем вывод о типе реакции гидролиза; выясним, в чем же различие и сходство гидролиза неорганических и органических веществ.
По ходу вы должны будете составить схему-конспект урока. Для этого у вас на столах имеется логическая схема, которая вам поможет.
Итак, вам было дано опережающее задание. Вы должны были повторить состав солей, вспомнить те органические вещества, которые подвергаются гидролизу.
В начале, ребята, заслушаем небольшой доклад о практическом значении гидролиза.
Итак, вы видите, что значение гидролиза велико, поэтому нам необходимо вспомнить: что такое гидролиз?
Гидролиз (от греческих слов «гидро» - вода и «лизео» - разлагаю) означает разложение водой. Повторим определение 2-3 раза и комментировано, согласно логической схеме, запишем его в тетрадь.
Такое определение охватывает гидролиз как неорганических, так и органических веществ. Гидролизу подвергаются простые вещества, соли, карбиды, гидриды и многие органические вещества: белки, жиры, углеводы.
Гидролиз в неорганической химии мы будем рассматривать на примере солей.
Вспомните и дайте определение солям. Соли – это сложные вещества, состоящие из катионов металлов и анионов кислотного остатка, полученные в результате реакции нейтрализации. Все ли соли одинаковы?
Они различаются образующими их основаниями и кислотами.
Так как все вещества различаются по степени диссоциации, то их делят на сильные и слабые электролиты. Тогда можно спросить: «Какие случаи образования солей вам известны?»
Известны следующие случаи образования солей:
слабое основание + сильная кислота
сильное основание + слабая кислота
сильное основание + сильная кислота
слабое основание + слабая кислота
Запишите их, согласно схеме, в тетрадь.
Для того, чтобы выяснить, все ли соли подвергаются гидролизу, необходимо провести лабораторное исследование; для этого вам выданы три раствора солей. У вас на столах имеются методички, определяющие порядок ваших действий.
Обратим внимание на доску! Что мы должны вспомнить?!
Правила ТБ.
Теория – практика.
Минимум – реактивов.
Максимум – внимания!
В начале ваших лабораторных исследований проведем контрольный эксперимент.
Прошу одного ученика – у доски – выполнить контрольный эксперимент. Работая, учащийся комментирует свои действия.
Затем мы анализируем результат эксперимента и краткую запись делаем в тетради, согласно записи в логической схеме:
 H2O л-с фиол. ср.н. [H+] = [OH-]
H2O л-с фиол. ср.н. [H+] = [OH-]
 NaOH л-с синий ср. из. [H+] OH-]
NaOH л-с синий ср. из. [H+] OH-]
 HCl л-с розовый ср. к. [H+] [OH-]
HCl л-с розовый ср. к. [H+] [OH-]
Теперь проведем лабораторное исследование. Что же вы наблюдаете? Дайте объяснение наблюдаемому явлению.
![]()
Na Cl + л-с (не изменил свою окраску)
NaOH HCl
с.о. с.к.
Сверим с контрольным экспериментом. Предполагаем, что среда раствора данной соли нейтральна. Предлагаю учащимся записать это в тетрадь, согласно схеме, и записать уравнение гидролиза в молекулярном и ионном виде:
NaCl + H2O  NaOH + HCl
NaOH + HCl
Na+ + Cl- + HOH  Na+ + OH- + H+ + Cl-
Na+ + OH- + H+ + Cl-
[OH-] = [H+]
ср. нейтральная
В чем же причина такого гидролиза соли?
Сильному учащемуся даю слово. Прошу повторить 1-2 слабых учащихся. Комментированно записываем причину в тетради по схеме:
«Связывание ионов не происходит».
![]()
Al Cl3 + л-с (розовый)
Al(OH)3 HCl
сл.о. с.к.
Ученик объясняет данные лабораторного анализа и контрольного эксперимента. Работаем аналогично, делаем записи в тетрадь по схеме. Записываем уравнение реакции гидролиза данной соли:
AlCl3 + H2O  AlOHCl2 + HCl
AlOHCl2 + HCl
Al3+ + 3Cl- + HOH  AlOH2+ + 2Cl- + H+ + Cl-
AlOH2+ + 2Cl- + H+ + Cl-
Al3+ + HOH  AlOH2+ + H+
AlOH2+ + H+
[OH-] +]
ср. кислая
Выясняем причину гидролиза данной соли, повторяем ее 2-3 раза и комментировано записываем в тетради по логической схеме:
«Катионы Men+ связывают OH- молекулы воды и освобождают H+»
![]()
K2 CO3 + л-с (синий).
KOH H2CO3
с.о. сл.к.
Объясняем наблюдаемое явление, сравниваем с контрольным экспериментом. Записываем данные в тетрадь. Записываем уравнение реакции гидролиза данной соли. Объясняем причину гидролиза.
K2CO3 + H2O KHCO3 + KOH
KHCO3 + KOH
2K+CO32+ + HOH K+ + HCO3- + K+ + OH-
K+ + HCO3- + K+ + OH-
CO32+ + HOH HCO3- + OH-
HCO3- + OH-
[H+] OH-] ср. щелочная
Причину гидролиза также повторяем несколько раз и комментированно записываем в тетрадь, согласно схеме:
«Анионы кислоты связывают H+ молекулы воды и освобождают OH-».
Сделаем вывод, чем же характеризуется гидролиз солей, в чем же его сущность? Вывод, сделанный учащимися, также повторяем 2-3 раза и комментированно записываем в тетрадь, согласно логической схеме:
«Гидролиз соли – реакции обмена солей с водой, приводящие к образованию слабых электролитов».
Гидролиз в органической химии мы рассмотрим теоретически, так как лабораторное исследование очень сложное и длительное по времени. Некоторые учащиеся получили опережающее задание и мы сейчас заслушаем их информацию.
Жиры представляют собой смесь сложных эфиров трехатомного спирта – глицерина и высших карбоновых кислот. Для жиров наиболее характерной является реакция гидролиза (омыление). Гидролиз легко протекает при температуре, в присутствии катализатора: кислот, щелочей, оксидов. Схему гидролиза жиров учащиеся переносят в тетрадь согласно логической схеме:

![]()
![]()

H2C – O – OC – R HO – H кат-р H2C – OH

![]()
![]()
HC – O – OC – R + HO – H HC – OH + 3R – COOH
H2C – O – OC – R HO – H р.обратима H2C – OH карбоноваякислота
глицерин
Углеводы также подвергаются гидролизу. Гидролиз рассмотрим на примере сахарозы.
C12H22O11 – сахароза

C12H22O11 + H2O t C6H12O6 + C6H12O6
глюкоза фруктоза
Белки. Основные сведения о них были получены при изучении продуктов их гидролиза. Гидролиз происходит при температуре с растворами кислот или щелочей при действии ферментов.
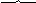

пептидная связь
Внимательно посмотрите на записи и подумайте: в чем же сущность гидролиза органических веществ? Вывод, сделанный учащимися, повторяем 2-3 раза и комментированно записываем в тетрадь, согласно логической схеме:
«Гидролиз проходит в присутствии катализаторов (ферментов) по принципу: в органических веществах разрывается определенная связь и освобождающиеся валентности используются для присоединения групп Н+ и ОН- из молекул воды».
Итак, ребята, мы рассмотрели гидролиз органических и неорганических веществ, а теперь сравним полученные знания и попробуем найти, в чем же сходство?
«Гидролиз – взаимодействие веществ с водой»
и в чем различие?
«Реакция среды в органических веществах не изменяется».
Комментированно записываем их в тетрадь и заканчиваем оформление конспекта урока.
Подводим итог, еще раз повторяем, в чем же сущность гидролиза, в чем сходство и различие гидролиза органических и неорганических веществ.
Выставляю оценки работающим учащимся, комментирующим. Даю домашнее задание по конспекту повторить гидролиз веществ.




![]()
Гидролиз – «разложение» веществ водой н.в.
г-з
 н.в. орг.в.
н.в. орг.в.


![]()

![]() соли |
с.о. + сл.к. NaCl, K2CO3, Al2S, ZnS жиры

 сл.о. + с.к. NaCl
сл.о. + с.к. NaCl Na+ + Cl- орг.в. белки
Na+ + Cl- орг.в. белки

 сл.о. + сл.к. ? углеводы
сл.о. + сл.к. ? углеводы
 НЕОРГАНИЧЕСКАЯ ХИМИЯ ОРГАНИЧЕСКАЯ ХИМИЯ
НЕОРГАНИЧЕСКАЯ ХИМИЯ ОРГАНИЧЕСКАЯ ХИМИЯ



 Д.О. H2O л – с фиол. [H+] = [OH-] б.ц. ф – ф H2O Углеводы
Д.О. H2O л – с фиол. [H+] = [OH-] б.ц. ф – ф H2O Углеводы

 К.Э NaOH л – с син. [OH-] мал. ф – ф NaOH 1. Сахароза 2. Крахмал
К.Э NaOH л – с син. [OH-] мал. ф – ф NaOH 1. Сахароза 2. Крахмал


 HCl л – с роз. [H+] - ф – ф HCl C12H22O11 C6H12O6+C6H12O6 (C6H10O5)n t, вода nC6H12O6
HCl л – с роз. [H+] - ф – ф HCl C12H22O11 C6H12O6+C6H12O6 (C6H10O5)n t, вода nC6H12O6
Л.О. Причина гидролиза глюкоза, фруктоза глюкоза




![]()
фиол. NaCl + H2O NaOH + HCl связывание ионов Жиры
NaOH + HCl связывание ионов Жиры

![]() Na Cl л-с Na++Cl- + HOH
Na Cl л-с Na++Cl- + HOH Na++OH- + H++Cl- не происходит O
Na++OH- + H++Cl- не происходит O
![]()
![]()




 NaOH HCl ф-ф б.ц. [OH-] = [H+] H2C – O – C HO H H2C – OH с.о. с.к. ср.н. R
NaOH HCl ф-ф б.ц. [OH-] = [H+] H2C – O – C HO H H2C – OH с.о. с.к. ср.н. R


 O t, k
O t, k


![]()
роз. AlCl3+ H2O AlOHCl2 + HCl катионыМе HC – O – C + HO H HC – OH + 3COOR
AlOHCl2 + HCl катионыМе HC – O – C + HO H HC – OH + 3COOR
![]()


![]() Al Cl3 л-с Al3++3Cl- + HOH
Al Cl3 л-с Al3++3Cl- + HOH AlOH2++2Cl- + H++Cl- связывают ОН- R карб.кис-та
AlOH2++2Cl- + H++Cl- связывают ОН- R карб.кис-та


Al(OH)3 HCl ф-ф б.ц. Al3++HOH AlOH2++H+ молекулы Н2О и O
AlOH2++H+ молекулы Н2О и O
сл.о. с.к. [OH-] H+] освобождают Н+ H2C – O – C HO H H2C – OH


![]()
ср.к. R син. K2CO3+ H2O KHCO3 + KOH анионы кислоты Белки
KHCO3 + KOH анионы кислоты Белки
![]() K2 CO3 л-с 2K++CO32- + HOH
K2 CO3 л-с 2K++CO32- + HOH K++HCO3- + K++OH- связывают Н+ - R – CO – NH – R2 - + HOH …. аминокислоты
K++HCO3- + K++OH- связывают Н+ - R – CO – NH – R2 - + HOH …. аминокислоты
 KOH H2CO3 ф-ф мал. CO32++HOH
KOH H2CO3 ф-ф мал. CO32++HOH HCO3-+OH- молекулы Н2О и пептидная связь
HCO3-+OH- молекулы Н2О и пептидная связь
 с.о. сл.к. [H+] OH-] освобождают ОН- Вывод: гидролиз проходит в присутствии катализаторов (ферментов)
с.о. сл.к. [H+] OH-] освобождают ОН- Вывод: гидролиз проходит в присутствии катализаторов (ферментов)
 ср.из. по принципу: в орг. веществах разрывается определенная связь и
ср.из. по принципу: в орг. веществах разрывается определенная связь и
Вывод: гидролиз соли – реакции обмена солей с водой, приводящие освобождающиеся валентности используются для присоединения
к образованию слабых электролитов. гр. Н+ и ОН- из молекулы воды.
Сходство:
Гидролиз – взаимодействие веществ с водой.
Различие:
Реакция среды в органических веществах не изменяется

 Получите свидетельство
Получите свидетельство Вход
Вход



 H2O л-с фиол. ср.н. [H+] = [OH-]
H2O л-с фиол. ср.н. [H+] = [OH-] NaOH л-с синий ср. из. [H+] OH-]
NaOH л-с синий ср. из. [H+] OH-]  NaOH + HCl
NaOH + HCl














 Гидролиз в органической и неорганической химии (94.93 КB)
Гидролиз в органической и неорганической химии (94.93 КB)
 0
0 1797
1797 237
237 Нравится
0
Нравится
0


