1. Паспорт РАБОЧЕЙ ПРОГРАММЫ УЧЕБНОЙ ДИСЦИПЛИНЫ ХИМИЯ
1. 1. Область применения программы
Рабочая программа учебной дисциплины «Химия» является частью основной профессиональной образовательной программы (далее ОПОП) по профессиям:
150709. 02 «Сварщик»; 190631. 01 «Автомеханик»; 230103. 02 «Мастер по обработке цифровой информации»
Данная рабочая программа разработана на основании Федерального государственного образовательного стандарта по вышеназванным профессиям и в соответствии с Примерной программой учебной дисциплины Химия для профессий начального профессионального и специальностей среднего профессионального образования (2008 г. ) одобренной ФГУ «Федеральный институт развития образования» (10. 04. 2008 г. ) и рекомендованной Департаментом государственной политики и нормативно - правового регулирования в сфере образования Минобрнауки России (16. 10. 2008 г. )
Рабочая программа является основным документом нормативного компонента комплексного методического обеспечения по дисциплине химия и служит основой для разработки календарно - тематического плана
1. 2. Место дисциплины в структуре основной профессиональной образовательной программы:
дисциплина входит в общеобразовательный естественнонаучный цикл.
1. 3. Цели и задачи дисциплины – требования к результатам освоения дисциплины:
В результате освоения дисциплины обучающийся должен уметь:
называть: изученные вещества по «тривиальной» или международной номенклатурам;
определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, пространственное строение молекул, тип кристаллической решетки, характер среды в водных растворах, окислитель и восстановитель, направление смещения равновесия под влиянием различных факторов, изомеры и гомологи, принадлежность веществ к разным классам неорганических и органических соединений; характер взаимного влияния атомов в молекулах, типы реакций в неорганической и органической химии;
характеризовать: s - , p - , d - элементы по их положению в Периодической системе Д. И. Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и свойства органических соединений (углеводородов, спиртов, фенолов, альдегидов, кетонов, карбоновых кислот, аминов, аминокислот и углеводов);
объяснять: зависимость свойств химического элемента и образованных им веществ от положения в Периодической системе Д. И. Менделеева; зависимость свойств неорганических веществ от их состава и строения, природу химической связи, зависимость скорости химической реакции от различных факторов;
выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ, получению конкретных веществ, относящихся к изученным классам соединений;
проводить расчеты по химическим формулам и уравнениям реакций;
осуществлять самостоятельный поиск химической информации с использованием различных источников (справочных, научных и научно - популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
В результате освоения дисциплины обучающийся должен знать:
роль химии в естествознании, ее связь с другими естественными науками, значение в жизни современного общества;
важнейшие химические понятия: вещество, химический элемент, атом, молекула, масса атомов и молекул, ион, радикал, аллотропия, изотопы, атомные s - , p - , d - орбитали, химическая связь, электроотрицательность, валентность, степень окисления, пространственное строение молекул, моль, молярная масса, молярный объем газообразных веществ, вещества молекулярного и немолекулярного строения, дисперсные системы, электролитическая диссоциация, кислотно - оснóвные реакции в водных растворах, гидролиз, окисление и восстановление, электролиз, скорость химической реакции, механизм реакции, катализ, тепловой эффект реакции, химическое равновесие, углеродный скелет, функциональная группа, гомология, структурная и пространственная изомерия, основные типы реакций в неорганической и органической химии;
основные законы химии: закон сохранения массы веществ, закон постоянства состава веществ, Периодический закон Д. И. Менделеева, закон Авогадро;
основные теории химии; строения атома, химической связи, электролитической диссоциации, кислот и оснований, строения органических и неорганических соединений классификацию и номенклатуру неорганических и органических соединений;
природные источники углеводородов и способы их переработки;
вещества и материалы, широко используемые в практике: основные металлы и сплавы, графит, кварц, минеральные удобрения, минеральные и органические кислоты, щелочи, аммиак, углеводороды, фенол, анилин, метанол, этанол, этиленгликоль, глицерин, формальдегид, ацетальдегид, ацетон, глюкоза, сахароза, крахмал, клетчатка, аминокислоты, белки, искусственные волокна, каучуки, пластмассы, жиры, мыла и моющие средства;
1. 4. Перечень формируемых компетенций:
Содержание учебной дисциплины направлено на формирование
- общих компетенций, включающих в себя способность:
ОК 1. Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес.
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
ОК 3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность.
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
ОК 5. Использовать информационно - коммуникационные технологии в профессиональной деятельности.
ОК 6. Работать в коллективе и в команде, эффективно общаться с коллегами, руководством, потребителями.
ОК 7. Брать на себя ответственность за работу членов команды (подчиненных), за результат выполнения заданий.
ОК 8. Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать повышение квалификации.
ОК 9. Ориентироваться в условиях частой смены технологий в профессиональной деятельности.
ОК 10. Исполнять воинскую обязанность, в том числе с применением полученных профессиональных знаний (для юношей).
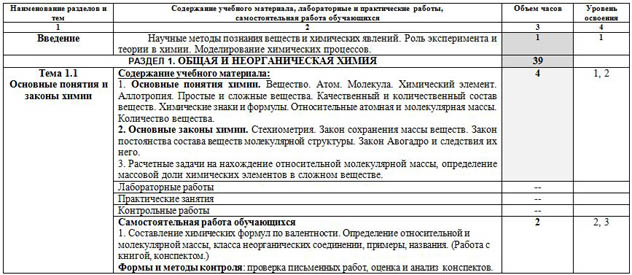
Весь материал – смотрите документ.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Рабочая программа дисциплины "Химия" для профессий НПО (0.64 MB)
Рабочая программа дисциплины "Химия" для профессий НПО (0.64 MB)
 0
0 929
929 13
13 Нравится
0
Нравится
0




