
МАСТЕР- КЛАСС ПО ХИМИИ
Гидролиз неорганических веществ –солей.
УЧИТЕЛЬ ХИМИИ МБОУ СОШ №1 с.ГИЗЕЛЬ Солтанова В.К.

Тип урока : изучение нового материала.
Вид урока: проблемно-исследовательский.

Цели урока:
- Сформировать представление о гидролизе, сущности гидролиза солей; научить составлять уравнения реакций гидролиза солей в молекулярном и ионном виде, определять реакцию и тип среды раствора электролита на основании состава соли.

Задачи урока:
- 1.Развивать у школьников умение пользоваться опорными знаниями, закрепить умения и навыки химического эксперимента, умение работать с таблицами, справочными материалами . 2.Развивать мышление, умение делать логические выводы из наблюдений по опыту. Научить составлять ионное уравнение реакции гидролиза солей по первой ступени. 3.Сформировать понимание практического значения гидролиза в природе и жизни человека.

Оборудование:
- H 2 O (ДИСТИЛ.), AlCl 3 , Na 2 CO 3 (тв.), NaCl, CuCl 2, универсальные индикаторы , спиртовки, пробирки , держатели.

ЭКСПЕРИМЕНТ.
- Определение реакции среды электролитов – растворов солей универсальным индикатором. AlCl 3 розовый цвет pH 7 (щелочная) NaCl зеленый цвет pH = 7( нейтр)

Гидролиз
- Гидролиз- взаимодействие соли с водой, в результате которого идет образование слабого электролита . Если кислота - кислая соль, если основание основная соль, и происходит изменение среды раствора. Гидролизу- процесс обратимый. Гидролизу подвергаются растворимые соли , в состав которых входит либо катион слабого электролита ,либо анион слабого электролита.

- Если катион слабого электролита- идет гидролиз по катиону. Если анион слабого электролита – идет гидролиз по аниону. Если катион и анион многозарядные – гидролиз идет ступенчато. Если в состав соли входят катион и анион слабых электролитов, идет необратимый гидролиз. Не подвергаются гидролизу соли, образованные катионами и анионами сильных электролитов, а также нерастворимые в воде соли.
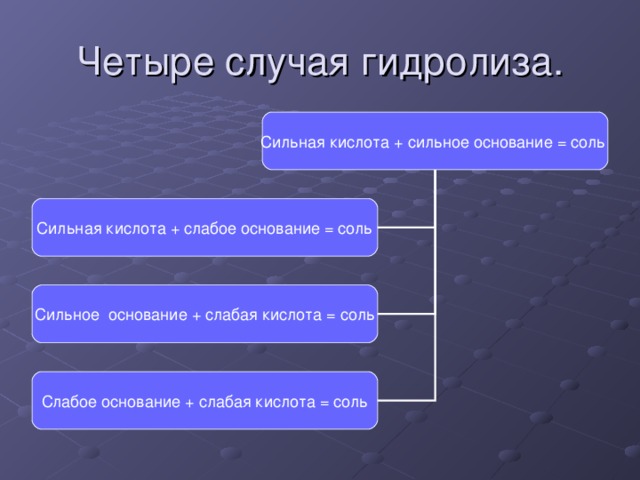
Четыре случая гидролиза.
Сильная кислота + сильное основание = соль
Сильная кислота + слабое основание = соль
Сильное основание + слабая кислота = соль
Слабое основание + слабая кислота = соль

Пример
- В эксперименте были соли : AlCl 3 – соль образована слабым электролитом – основанием Al(OH) 3 , сильной кислотой – соляной , гидролизуется по катиону . Na 2 CO 3 – соль образована сильным основанием NaOH и слабой кислотой H 2 CO 3 – угольной, гидролизуется по аниону. NaCl – соль образована сильным основанием NaOH и сильной кислотой HCl , гидролиза нет.

Алгоритм составления уравнения гидролиза соли.
- 1.По химической формуле соли определить, какой кислотой и каким основанием образована соль. 2. Записать левую часть уравнения в молекулярном виде . 3. Составить уравнение в общем ионном виде, предположим, согласно этому уравнению, продукты правой части уравнения в молекулярном виде. 4. Сократить одинаковые ионы в левой и правой частях уравнения общего ионного вида. 4.Составить уравнение гидролиза в кратком виде, определить среду.
 7. " width="640"
7. " width="640"
Пример
- 1. Na 2 CO 3 --- соль образована NaOH – сильное основание, H 2 CO 3 – слабая кислота, гидролиз по аниону ; 2. Na 2 CO 3 + HOH ↔ NaHCO 3 + NaOH; 3. 2Na + CO 3 ²‾ + HOH ↔ HCO 3 ‾ + 2Na + OH ‾ Предполагаем продукты правой части уравнения : соль NaHCO3 и основание NaOH; записываем в правую часть молекулярного уравнения;
4. Составляем краткое ионное уравнение гидролиза , сокращаем катионы натрия :
CO 3 ²‾ + HOH ↔ HCO 3 ‾ + OH ‾
Вывод: среда щелочная ; pH7.

Общий вывод.
- Соли подверглись гидролизу , вследствие чего раствор вызвал определенную реакцию среды.

Если следует дать ответ быстро, не составляя уравнения гидролиза соли, следует помнить: «сильное пересиливает слабое» Определить, какими по силе электролитами образована соль, если сильным основанием- щелочная реакция среды, если сильной кислотой- среда кислая, если и основание, и кислота сильные- реакция среды нейтральная.
- Пример. Какую реакцию среды имеют растворы солей CuSO 4 , KNO 2 ,Na 2 SO 4 ? CuSO 4 - реакция среды кислая, т.к. соль образована сильной кислотой- серной. KNO 3 – реакция среды щелочная, т.к. соль образована сильным основанием. Na 2 SO 4 – реакция среды нейтральная, т.к. соль образована сильной кислотой и сильным основанием.

Необратимый гидролиз.
- Необратимому (полному) гидролизу подвергаются соли, образованные слабым нерастворимым основанием и слабой летучей или нерастворимой кислотой, а также галогениды неметаллов, фосфиды, карбиды, нитриды металлов. Al 2 S 3 образована слабой кислотой- H 2 S и слабым основанием – Al(OH) 3 Al 2 S 3 + 6 H 2 O Al(OH) 3 ↓ +H 2 S ↑ Такие соли не существуют в водных растворах и получить их обменным путем в растворах не удается. 2AlCl 3 +3Na 2 S+6H 2 O 2Al(OH) 3 ↓ + 3H 2 S ↑ + 6NaCl

Факторы, влияющие на глубину протекания гидролиза.
- Процесс гидролиза зависит от: природы соли – Чем слабее электролит, образовавший соль, тем глубже протекает гидролиза; температуры – Гидролиз является эндотермическим процессом и повышение температуры, в соответствии с принципом
- Ле Шателье , смещает равновесие гидролиза в сторону образования продуктов реакции; концентрации гидролизующей соли – Уменьшение концентрации соли приводит к усилению гидролиза; влияние одноименных ионов – Согласно принципу Ле Шателье при добавлении в раствор соли гидролизующейся по катиону кислоты гидролиз замедляется, как и при добавлении щелочи в раствор соли, гидролизующейся по аниону.

Обобщение и выводы.
- 1. Гидролиз- ВЗАИМОДЕЙСТВИЕ СОЛИ С ВОДОЙ С ОБРАЗОВАНИЕМ СЛАБОГО ЭЛЕКТРОЛИТА И ИЗМЕНЕНИЕМ СРЕДЫ. 2. Г ИДРОЛИЗ – ОБРАТИМЫЙ ПРОЦЕСС. 3. В ОЗМОЖЕН ГИДРОЛИЗ а) ПО КАТИОНУ; б) ПО АНИОНУ. 4. Р ЕАКЦИЯ СРЕДЫ ЗАВИСИТ ОТ СООТНОШЕНИЯ КОНСТАНТ ДИССОЦИАЦИИ ЭЛЕКТРОЛИТОВ, ОБРАЗОВАВШИХ СОЛЬ. 5. Г ИДРОЛИЗ НЕОБРАТИМ В ТОМ СЛУЧАЕ, ЕСЛИ ХОТЯ БЫ ОДИН ИЗ ПРОДУКТОВ ГИДРОЛИЗА УХОДИТ ИЗ СФЕРЫ РЕАКЦИИ. О Н СРАЗУ ИДЕТ И ПО КАТИОНУ И ПО АНИОНУ.
Роль гидролиза в повседневной жизни человека
Роль гидролиза в народном хозяйстве.

ЗАДАНИЯ ЕГЭ ЧАСТИ А и В.
- 1.Н е подвергаются гидролизу соли , образованные 1) сильным основанием и слабой кислотой 2) слабым основанием и сильной кислотой 3) сильным основанием и сильной кислотой 4) однокислотным основанием и двухосновной кислотой
- 2. Кислую реакцию среды имеет раствор 1) Ca(NO 3 ) 2 2)NaCl
3) NaHSO 4 4) K 2 SO 3

Установите соответствие между названием соли и отношением ее к гидролизу.
- А) нитрат калия Б)сульфид бария В)хлорид алюминия Г)карбонат натрия
- 1) гидролиз по катиону 2) гидролиз по аниону 3)гидролиз по катиону и аниону 4) не гидролизуется

Домашнее задание §16,упр.1-6,9.


 Получите свидетельство
Получите свидетельство Вход
Вход













 7. " width="640"
7. " width="640"



















 Гидролиз неорганических веществ-солей (9.3 MB)
Гидролиз неорганических веществ-солей (9.3 MB)
 0
0 1766
1766 119
119 Нравится
0
Нравится
0


