Цель урока: Рассмотреть строение атомов галогенов, степени окисления и их физические свойства. Строение молекул галогенов Изучить химические свойства.
Оборудование :Образцы галогенов, металлов (натрий, алюминий), растворы NaBr, NaI,.учебник О.С.Габриеляна, Химия , 9 класс.
ХОД УРОКА
I. Организационный момент
II. Проверка домашнего задания
Работают на доске (Упр. №3, 4)
Экспресс-опрос класса
Назовите особенности атомного строения неметаллов.
Что такое ЭО? Какой элемент самый электроотрацательный?
Что можно сказать о физических свойствах неметаллов?
Назовите основные причины аллотропии.
Что показывает число Авогадро? Чему равна эта величина?
III. Изучение нового материала
Где находятся в ПСХЭ
A) щелочные металлы
Б) щелочноземельные
В) халкогены
Г) галогены
Характеристика по плану (по положению галогенов в ПСХЭ)(Работа на доске)
-- положение в периодической системе (период, ряд, группа, п/группа, )
-- атомное строение (электроны, протоны, нейтроны), Аr
-- электронные слои, количество электронов в слоях, электронная конфигурация, заполнения электронами электронной ячейки
-- высшие оксиды, летучие водородные соединения.
Просмотр КМ школы (закрепление)
КМ школа (первый абзац)
Вывод
С увеличением порядкового номера увеличивается число энергетических уровней в атоме, связь электронов с ядром ослабевает, поэтому ослабляется способность к оттягиванию чужих электронов , и окислительные свойства в группе ослабевает
С ослабление окислительной способности означает, ослабление неметаллических свойств, т.е. усилениями металлических свойств.
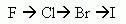
уменьшение окислительной активности галогенов
усиление восстановительной активности галогенов
С.О. -1, +1,+3,+5,+7; (только для фтора ,как самый электроотрицательный элемент с.о. только -1)КМ-школа
Физические свойства (Работа с учебником О.С. Габриеляна , Химия 9 класс , 105 стр. ,таблица)
Запись в тетрадях физических свойств галогенов.(фтор, хлор -газы ,бром-жидкость, йод, астат- твердые вещества)
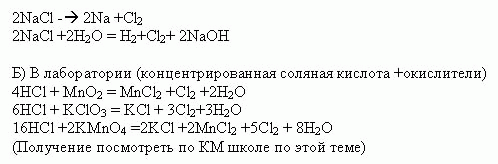
ПОЛУЧЕНИЕ ГАЛОГЕНОВ
1. В промышленности
А) Электролизом расплавов и растворов
ХИМИЧЕСКИЕ СВОЙСТВА
1. Общая формула галогенов – Г2
2. Тип химической связи: ковалентная неполярная (составление электронной формулы Г –Г )
Взаимодействие галогенов с металлами, образуется соли
F—реагирует при обычных условиях, при нагревании и с золотом , серебром, платиной.
Al u Zn—в атмосфере фтора воспламеняются
Zn +F2 =ZnF2
2Al +3 F2 = 2Al F3
Остальные галогены реагируют обычно при нагревании
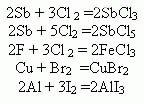
Взаимодействие с не Ме.(при нагревании)
Физкульт минутка

Взаимодействие галогенов с водородом
Фтор реагирует с водородом без нагревания, идет в темноте, хлор –на свету, бром- при нагревании, йод- при более сильном нагревании. Первые три реакции экзотермические, последняя—слабо эндотермическая, протекает медленно даже при нагревании.
H2 + Г2 =2НГ
Открытие галогенов. Самостоятельное изучение по учебнику О.С.Габриеляна, Химия -9 класса стр.109
Специфичные реакции:
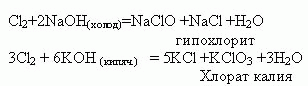
IV. Закрепление. Упражнение № 4 стр 110
V. Домашнее задание параграф18 стр 104-109. записи в тетрадях.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Галогены — простые вещества (67.72 KB)
Галогены — простые вещества (67.72 KB)
 0
0 441
441 7
7 Нравится
0
Нравится
0




