
Электролиз

Содержание :
1 . Определение сущности процесса электролиза 2. Электролиз в расплавах : а) процессы на катоде б) процессы на аноде
в) примеры электролиза в расплавах электролитов 3. Электролиз в растворах :
а) процессы на катоде б) процессы на аноде
в) примеры электролиза в растворах электролитов
4. Области использования электролиза: а) получение чистых металлов б) очистка металлов в) получение щелочей, галогенов, водорода г) гальваностегия в) гальванопластика г) косметология
5. Тест по теме «Электролиз»
6. Домашнее задание
7.Список использованной литературы и Интернет-ресурсов

Электролиз – это окислительно-восстановительный процесс, протекающий на электродах в растворах или расплавах электролитов при пропускании электрического тока. Сущность электролиза заключается в том, что за счет электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно.

Электролиз в расплавах На катоде происходит процесс восстановления
• В расплавах катионы металла восстанавливаются до свободного металла:
М n+ + nē = М 0

Электролиз в расплавах На аноде происходит процесс окисления
• В расплавах анионы бескислородных кислот (кроме фторидов) окисляются до соответствующего простого вещества, например:
2Cl – – 2ē = Cl 2 0
• Кислородсодержащие анионы выделяют кислород и превращаются в один из оксидов:
SO 4 2– – 2ē = SO 2 0 + O 2 0 .
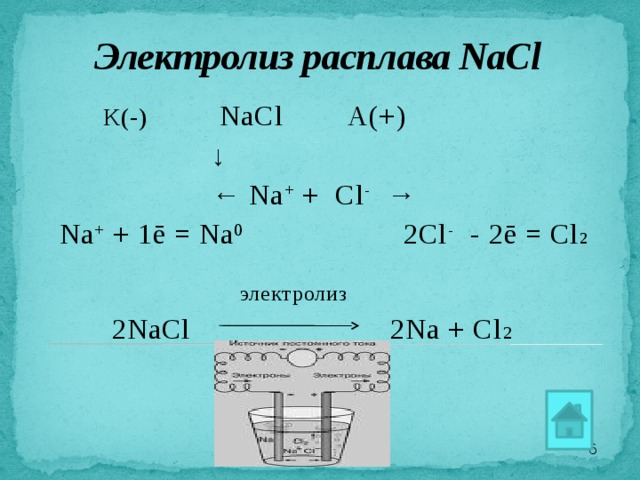
Электролиз расплава NaCl
К(-) NaCl А(+)
↓
← Na + + Cl - →
Na + + 1ē = Na 0 2Cl - - 2ē = Cl 2
электролиз
2NaCl 2Na + Cl 2

Электролиз расплава CuCl 2
К(-) CuCl 2 А(+)
↓
← Cu 2+ + 2Cl - →
Cu 2+ + 2ē = Cu 0 2Cl - - 2ē = Cl 2
CuCl 2 Cu + Cl 2
электролиз
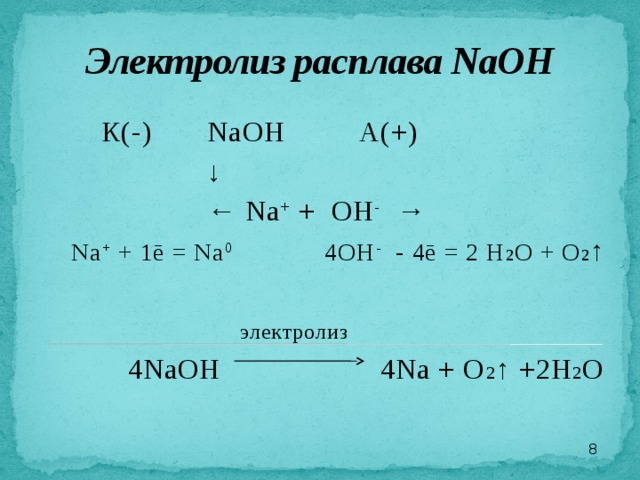
Электролиз расплава NaOH
К(-) NaOH А(+)
↓
← Na + + OH - →
Na + + 1ē = Na 0 4OH - - 4ē = 2 H 2 O + O 2 ↑
электролиз
4NaOH 4Na + O 2 ↑ +2H 2 O

Электролиз в растворах (процесс на катоде)
- В растворах процесс на катоде не зависит от материала катода, а зависит от активности восстанавливаемого металла.
а) Если металл расположен в ряду напряжений от Li до Al включительно, то на катоде идет процесс восстановления воды:
2Н 2 О + 2ē = H 2 0 + 2OH –

Электролиз в растворах (процесс на катоде)
б) Если металл расположен в ряду напряжений между Al и H 2 , то на катоде идут одновременно процессы восстановления воды и катионов металла:
2Н 2 О + 2ē = H 2 0 + 2OH – М n+ + nē = М 0
в) Если металл расположен в ряду напряжений после Н 2, то на катоде идет процесс восстановления катионов металла: М n+ + nē = М 0
При электролизе растворов кислот идет процесс восстановления ионов водорода: 2Н + + 2ē = H 2 0

Процесс на аноде
В растворах процесс на аноде зависит от материала анода и от природы аниона. Аноды могут быть двух видов – растворимые (железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза) и нерастворимые , или инертные (уголь, графит, платина, золото)
а) Если анод растворимый , то независимо от природы аниона всегда идет окисление металла анода, например:
Cu 0 – 2ē = Cu 2+

Процесс на аноде
б) Если анод инертный , то в случае бескислородных анионов (кроме фторидов) идет окисление анионов:
2Cl – – 2ē = Cl 2 0
В случае кислородсодержащих анионов и фторидов идет процесс окисления воды, анион при этом не окисляется и остается в растворе:
2H 2 O – 4ē = O 2 0 + 4H +
При электролизе растворов щелочей идет окисление гидроксид-ионов:
4OH – – 4ē = O 2 0 + 2H 2 O

Электролиз раствора NaCl на инертном аноде
К(-) NaCl А(+)
↓
← Na + + Cl - →
2Н 2 О + 2ē = H 2 + 2OH - 2Cl - - 2ē = Cl 2 ↑
электролиз
2NaCl + 2H 2 O H 2 + Cl 2 +2NaOH

Электролиз раствора CuSO 4 на инертном аноде
К(-) CuSO 4 А(+)
↓
← Cu 2+ + SO 4 2- →
Cu 2+ + 2ē = Cu 0 2H 2 O – 4ē = O 2 ↑ + 4H +
электролиз
2CuSO 4 + 2 H 2 O 2Cu + O 2 + 2 H 2 SO 4

Электролиз раствора NaCl на растворимом аноде
К(-) NaCl А(+)
↓ (Cu)
← Na + + Cl - →
Cu 2+ + 2ē = Cu 0 Cu 0 – 2ē =Cu 2+
(т.к. Cu 2+ в ряду напряжений
стоят после H + )
Происходит переход ионов меди с анода на катод. Концентрация NaCl в растворе не меняется.

Применение электролиза:
- получение чистых металлов (Алюминий, магний, натрий, кадмий получают только электролизом)

- очистка металлов

- получение щелочей, хлора, водорода

- защита металлов от коррозии (При этом на поверхности металлических изделий электрохимическим методом наносят тонкий слой другого металла, устойчивого к коррозии). Этот раздел гальванотехники называется ГАЛЬВАНОСТЕГИЯ (от гальвано... и греч. stego - покрываю)

- копирование рельефных изделий из металлов и других материалов. Гальванопластика позволяет создавать документально точные копии барельефов, монет, гербов, медалей, эмблем и т.д. Широко применяется при реставрации.
- применение электролиза в косметологии для электроэпиляции (при удалении волос этим методом используются очень тонкие иголочки, которыми воздействуют на волосяной фолликул)

Тест по теме "Электролиз"
1. При электролизе раствора сульфата цинка с инертными электродами на аноде выделяется:
а) цинк; б) кислород; в) водород; г) сера.
2. При электролизе раствора хлорида натрия образуются: а) натрий и хлор; б) гидроксид натрия, хлор и водород; в) кислород и хлор; г) натрий, хлор и соляная кислота.

3 . При электролизе расплава гидроксида натрия на аноде выделяется: а) натрий; б) водород; в) кислород; г) вода
4. Платиновый электрод: а) инертный; б) растворимый; в) расходуется в процессе электролиза; г) не расходуется в процессе электролиза.

5. Процесс на катоде при электролизе растворов солей зависит от: а) природы катода; б) активности металла; в) состава аниона; г) не зависит от перечисленных факторов.
6. При электролизе раствора нитрата меди(II) с медными электродами на аноде будет происходить: а) выделение диоксида азота; б) выделение монооксида азота; в) растворение анода; г) выделение кислорода.

7. При электролизе 240 г 15%-го раствора гидроксида натрия на аноде выделилось 89,6 л (н.у.) кислорода. Массовая доля вещества в растворе после окончания электролиза равна (в %): а) 28,1; б) 32,1; в) 37,5; г) 40,5. 8 . Медный купорос массой 100 г растворили в воде и провели электролиз до обесцвечивания раствора. Объем (в л, н.у.) собранного газа равен: а) 2,24; б) 4,48; в) 11,2; г) 22,4.

А теперь проверим ваши ответы!
1-б 2-б 3-в, г 4-а, г 5-б 6- в 7- в 8-б

Домашнее задание:
Учебник О.С.Габриеляна Химия 11 класс § 18 (стр.217 - 222), упр. 22,23,25.

Список использованной литературы: 1. О.С.Габриелян Учебник химии для 11 класса, М., Дрофа, 2004г. Интернет – ресурсы: 1. http://www.nontoxicprint.com/electroetching.htm 2. http://dic.academic.ru/dic.nsf/enc_colier/3192/ ХИМИЧЕСКИЕ 3. http://atecom.ru/ru/hydrogen/ 4. http://festival.1september.ru/articles/564677/ 5. http://www.nickelca.ru/professions/metallurgy/ 6. http://t-coins.narod.ru/Hidro.htm 7. http://medicini.info/raznoe/165-udalenie-volos-metodom-elektroliza.html 8. http://www.bayertechnology.com/ru/produkty/khlor-ehlektroliz.html 9. http://www.interfax.by/article/4066

Спасибо за внимание!

 Получите свидетельство
Получите свидетельство Вход
Вход











 Электролиз 11 класс (2.71 MB)
Электролиз 11 класс (2.71 MB)
 0
0 1108
1108 91
91 Нравится
0
Нравится
0


