Репетиционный Единый Государственный Экзамен, апрель 2016 г. ХИМИЯ, 11 класс
ВАРИАНТ 1
1/12
Единый государственный экзамен по ХИМИИ
Инструкция по выполнению работы
Экзаменационная работа состоит из двух частей, включающих в себя 40 заданий. Часть 1 содержит 35 заданий с кратким ответом, в их числе 26 заданий базового уровня сложности и 9 заданий повышенного уровня сложности. Часть 2 содержит 5 заданий высокого уровня сложности с развёрнутым ответом.
На выполнение экзаменационной работы по химии отводится 3 часа (180 минут).
Ответы к заданиям 1-26 записываются в виде одной цифры, которая соответствует номеру правильного ответа. Эту цифру запишите в бланк ответов №1.
Ответы к заданиям 36-40 включают в себя подробное описание всего хода выполнения задания. В бланке ответов №2 укажите номер задания и запишите его полное решение.
Все бланки ЕГЭ заполняются яркими чёрными чернилами. Допускается использование гелевой, капиллярной или перьевой ручки.
При выполнении работы используйте Периодическую систему химических элементов Д.И. Менделеева; таблицу растворимости солей, кислот и оснований в воде; электрохимический ряд напряжений металлов.
Эти сопроводительные материалы прилагаются к тексту работы.
Для вычислений используйте непрограммируемый калькулятор.
Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Желаем успеха
Часть 1
| Ответами к заданиям 1-23 является цифра или последовательность цифр, которая соответствует номеру правильного ответа. Запишите ответ в поле ответа в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ №1 справа от номера соответствующего задания, начиная с первой клеточки. Последовательность цифр записывайте без пробелов, запятых и других дополнительных символов. Каждый символ пишите в отдельной клеточке в соответствии с приведенными в бланке образцами. |
1
Выберите элемент, электронная конфигурация внешнего энергетического уровня у которого ns
2np
1?
Ca 2) Li 3) B 4) Na
Ответ:
2
Оснóвные свойства оксидов уменьшаются в ряду
| 1) | Li2O → Na2O → K2O |
| 2) | BaO → SrO → CaO |
| 3) | FeO → K2O → MgO |
| 4) | Al2O3 → Na2O → MgO |
Ответ:
3
Только ковалентные связи имеет каждое из двух веществ:
1) CaO и C3H6
2) NaNO3 и CO
3) N2 и K2S
4) CH4 и SiO2
Ответ:
4
Среди перечисленных элементов постоянную степень окисления в соединениях проявляет:
1) свинец 2) медь 3) стронций 4) сера
Ответ:
5
Какой тип кристаллической решетки характерен для галогенов:
1) атомная 2) ионная 3) молекулярная 4) металлическая
Ответ:
6
Среди перечисленных веществ:
1) NH4NO2
2) Ca(HCO3)2
3) CuSO4·2H2O
4) NH4HSO4
5) HNO3
6) NaHSO3
кислыми солями являются:
Ответ:
7
Верны суждения о железе?
А. Железо относится к d- элементам
Б. Соединения железа в степени окисления +2 проявляют как окислительные, так и восстановительные свойства
верное только А
верно только Б
верны оба суждения
оба суждения неверны
Ответ:
8
Оксид серы (IV) взаимодействует с каждым из двух веществ:
1) HCl и CO2 3) NaOH и SiO2
2) О2 и Na2O 4) HNO3 и NaCl
Ответ:
9
С гидроксидом алюминия взаимодействует с каждое из двух веществ:
1) H3PO4 и CuS 3) NaCl и Na2CO3
2) KNO3 и SiO2 4) HNO3 и Ba(OH)2
Ответ:
10
С раствором хлорида меди (II) реагирует каждое из двух веществ:
1) AgNO3 и Na2CO3 3) NaOH и K2SO4
2) K2S и KNO3 4) Ba(OH)2 и NaNO3
Ответ:
Х1
Х2
11
В схеме превращений H
2SO
4 → K
2SO
4 → CaSO
4 веществами X1 и X2 являются соответственно
K3РО4 2) CaCO3 3) KOH
4) KCl 5) CaCl2 6) Ca3(PO4)2
Ответ:
12
| Какое соединение не является изомером бутанола-1? |
| | 1) | CH3–CH2–CH2–O–CH3 | | | 2) | CH3–CH–CH2–CH3 | OH | | | 3) | CH3–CH2–O–CH2–CH3 | | | 4) | CH3–CH2–C–CH3 || O |
|
Ответ:
13
С водородом взаимодействует каждое из двух веществ:
1) бензол, пропан 3) дивинил, этен
2) бутен, этан 4) дихлорэтан, бутан
Ответ:
14
При окислении этанола оксидом меди (II) при нагревании образуется
1) уксусная кислота 3) этиленгликоль
2) оксид углерода ((IV) и вода 4) уксусный альдегид
Ответ:
15
Верны ли следующие суждения о свойствах указанных кислородсодержащих органических соединений?
А. Метаналь взаимодействует с гидроксидом меди(II).
Б. Муравьиная кислота вступает в реакцию «серебряного зеркала».
верное только А
верно только Б
верны оба суждения
оба суждения неверны
Ответ:
16
|
| В лаборатории уксусную кислоту получают по схеме |
|
| | | 1) | O CH3 – C – H + H2  3) CH3CH2OH + O2 3) CH3CH2OH + O2  | | | 2) | O CH3 – C – ONa + H2SO4(к) 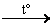 4) C4H10 + O2 4) C4H10 + O2  |
|
|
|
|
Ответ:
17
Аминоуксусная кислота взаимодействует с:
бензолом
хлороформом
магнием
толуолом
Ответ:
А18
В схеме превращений С
3Н
8 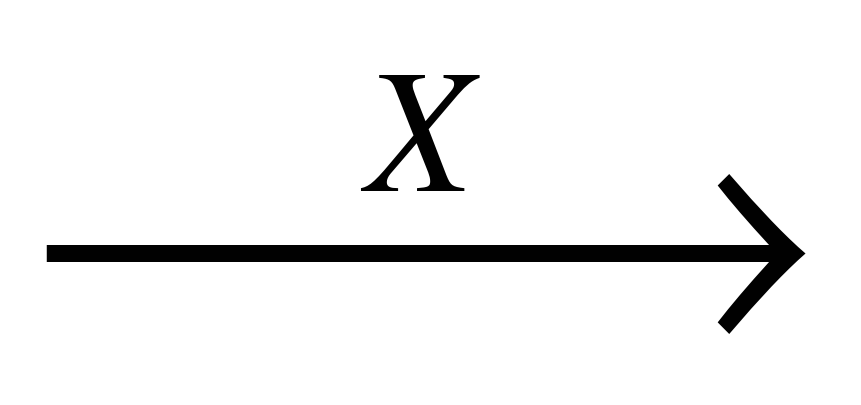
С
3Н
7Br
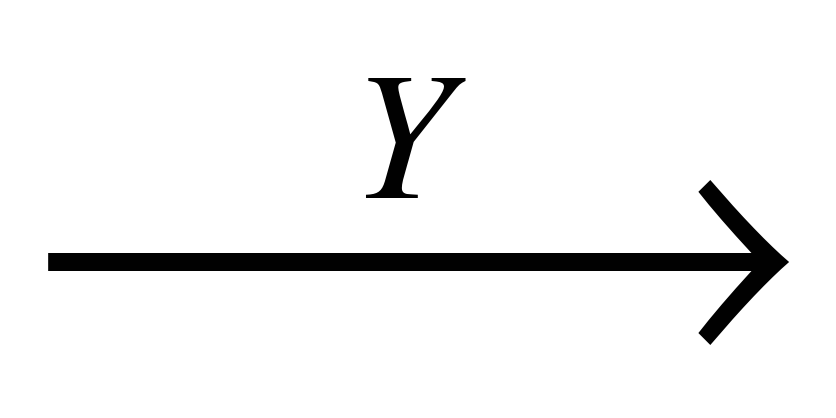
C
3H
7OH
веществами "Х" и "Y" являются соответственно
1) HBr 2) NaOH 3) H2O
4) Br2 5) Cu(OH)2
Ответ:
19
Взаимодействие пропилена с бромом при обычных условиях относится к реакции
1) присоединения 3) гидрогенизации
2) замещения 4) изомеризации
Ответ:
20
На скорость химической реакции
Zn + CuCl2 = ZnCl2 + Cu не оказывает влияния увеличение
температуры
давления
площади поверхности соприкосновения реагирующих веществ
концентрации раствора СuCl2
Ответ:
21
Реакция обмена между растворами соляной кислоты и гидроксида бария проходит до конца в результате взаимодействия ионов
1) Ba2+ и Cl-
2) Ba2+ и H+
3) OH- и Ba2+
4) OH- и H+
Ответ:
22
Верны ли следующие суждения о работе с газами?
А. Углекислый газ можно осушить, пропуская его через концентрированную серную кислоту.
Б. Для осушения хлороводорода можно использовать твёрдый гидроксид кальция.
верное только А
верно только Б
верны оба суждения
оба суждения неверны
Ответ:
23
Исходным мономером для
полистирола является
1) С6Н5–СН=СН2
2) СН2=СН–СН=СН2
3) СН2=СCl–СН=СН2
4) СНС–СН3
Ответ:
| Ответом к заданиям 24–26 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Затем перенесите это число в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с правой клеточки. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Единицы измерения физических величин писать не нужно. |
24
Смешали 80 г раствора нитрата натрия с массовой долей 5% и 200 г раствора этой же соли с массовой долей 8%. Масса нитрата натрия в полученном растворе составила _______ г. (Запишите число с точностью до целых.)
Ответ:
25
В соответствии с термохимическим уравнением реакции
2Cl2O7(г) = 2Cl2(г) + 7O2(г) + 570 кДж
Вычислите количество выделившейся теплоты при разложении оксида хлора(VII) массой 3,66 г ______ кДж (Запишите ответ с точностью до десятых)
Ответ:
26
Через раствор, содержащий 44,1 г серной кислоты, пропустили аммиак до образования средней соли. Объём (н.у.) прореагировавшего газа составил ________ л. (Запишите число с точностью до сотых.)
Ответ:
| В заданиях 27-35 к каждому элементу первого столбца подберите соответствующий элемент второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами. Получившуюся последовательность цифр перенесите В БЛАНК ОТВЕТОВ №1 без пробелов, запятых и других дополнительных символов. Цифры в ответе могут повторяться. |
27
Установите соответствие между названием соединения и общей формулой его гомологического ряда
НАЗВАНИЕ СОЕДИНЕНИЯ ОБЩАЯ ФОРМУЛА
А) пропен 1) CnH2n+2
Б) изопрен 2) CnH2n
В) нонан 3) CnH2n-2
Г) бензол 4) CnH2n–4
5) CnH2n–6
Ответ:
28
Установите соответствие между уравнением реакции и изменением степени окисления окислителя в данной реакции.
УРАВНЕНИЕ РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
А) 2NH3 + 2K = 2KNH2 + H2 1) -1 → 0
Б) H2S + K = K2S +H2 2) 0 → -1
В) 4NH3 + 6NO = 5N2 + 6H2O 3) +2 → 0
Г) 2H2S +3O2 = 2SO2 + 2H2O 4) +1 → 0
5) +4 → +2
6) 0 → -2
Ответ:
29
Установите соответствие между формулой соли и продуктом, образующимся при электролизе его водного раствора на инертном аноде.
ФОРМУЛА СОЛИ ПРОДУКТ НА АНОДЕ
А) NaI 1) H2
Б) BaCl2 2) I2
В) Ag NO3 3) NO
Г) KNO3 4) Cl2
5) N2
6) O2
Ответ:
30
Установите соответствие между названием соли и средой ее водного раствора.
|
| НАЗВАНИЕ СОЛИ |
| Среда раствора |
| А) | нитрат аммония | 1) | нейтральная |
| Б) | нитрит калия | 2) | кислая |
| В) | хлорид лития | 3) | щелочная |
| Г) | сульфид натрия |
|
|
|
|
|
|
|
Ответ:
31
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе.
УРАВНЕНИЕ РЕАКЦИИ НАПРАВЛЕНИЕ СМЕЩЕНИЯ
ХИМИЧЕСКОГОРАВНОВЕСИЯ
А) 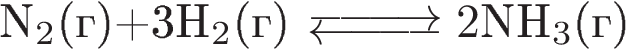 1) в сторону продуктов
1) в сторону продуктов
Б) 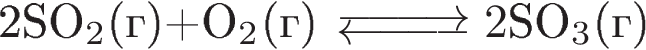 2) в сторону исходных веществ
2) в сторону исходных веществ
В) 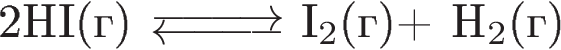 3) практически не смещается
3) практически не смещается
Г) 
Ответ:
32
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать
ФОРМУЛА ВЕЩЕСТВ РЕАГЕНТы
А) Cr(OH)3 1) LiOH, HNO3, HCl
Б) H2SO4 (разб) 2) NaOH, K2O, CuSO4
В) H2S 3) H2O, S, HNO3
Г) Ba 4) Zn, BaCl2, NaHS
5) NaNO3, CuO, SiO2
Ответ:
33
Установите соответствие между формулами двух веществ и реактивом, с помощью которого можно различить эти вещества:
| ФОРМУЛЫ ВЕЩЕСТВ | РЕАКТИВ |
| А) Al(NO3)3 и Ca(NO3)2 | 1) AlCl3 (р-р) |
| Б) Na3PO4 и Na2SO4 | 2) Br2 |
| В) KBr и HCl | 3) Fe |
| Г) KI и NaNO3 | 4) KOH (р-р) |
|
| 5) BaCl2 (р-р) |
|
|
|
|
|
|
|
|
|
Ответ:
34
Установите соответствие между углеводородом и продуктом, который преимущественно образуется при гидратации этого углеводорода:
| УГЛЕВОДОРОД | ПРОДУКТ ГИДРАТАЦИИ |
| А) этилен | 1) бутанол -1 |
| Б) бутен-1 | 2) бутанол -2 |
| В) пропин | 3) ацетон |
| Г) ацетилен | 4) пропаналь |
|
| 5) этанол |
|
| 6) уксусный альдегид |
Ответ:
35
Установите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
| А) CH3COOC2H5 + NaOH  | 1) этаналь |
| Б) C2H5OH + Na 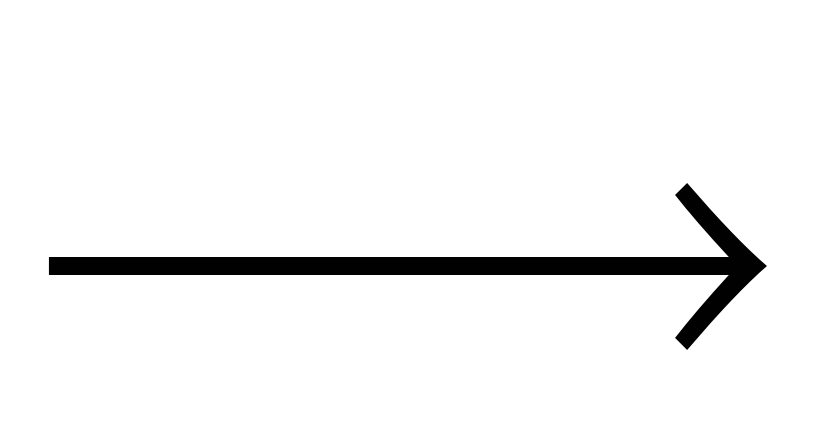 | 2) бутан |
| В) CH3COOC2H5 + H2O 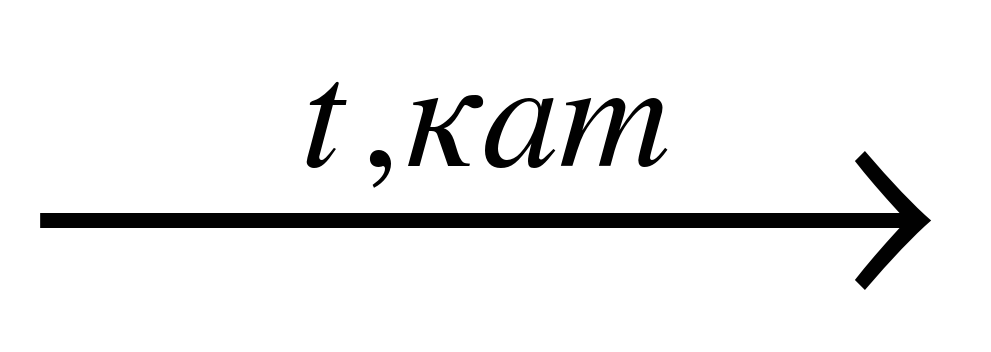 | 3) ацетат натрия |
| Г) C2H5OH + CuO 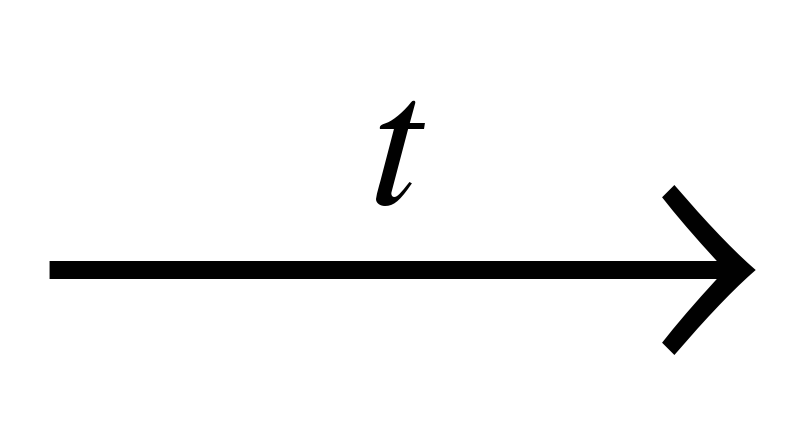 | 4) этановая кислота |
|
| 5) этилат натрия |
|
| 6) этилен |
Ответ:
Не забудьте перенести все ответы в бланк ответов №1 в соответствии с инструкцией по выполнению работы. перенесите его в бланк ответов № 1 без указания единиц измерения.
4/6
Часть 2
Для записи ответов на задания 36-40 используйте БЛАНК ОТВЕТОВ №2. Запишите сначала номер задания (36, 37 и т.д.), а затем его подробное решение. Ответы записывайте чётко и разборчиво.
36
Используя метод электронного баланса, составьте уравнение реакции
FeSO4 + KClO3 + … → ... + K2FeO4 + K2SO4 + H2O.
Определите окислитель и восстановитель.
Карбид алюминия полностью растворили в бромоводородной кислоте.
К полученному раствору добавили раствор сульфита калия, при этом наблюдали образование белого осадка и выделение бесцветного газа. Газ поглотили раствором дихромата калия в присутствии серной кислоты.
Образовавшуюся соль хрома выделили и добавили к раствору нитрата бария, наблюдали выделение осадка. Напишите уравнения четырёх описанных реакций.
37
38
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
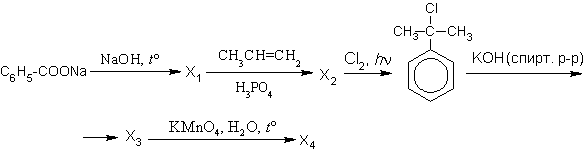
При написании уравнений реакций используйте структурные формулы органических веществ.
39
Газ, выделившийся при взаимодействии 7,4 г нитрида кальция с 9 г воды, полностью поглощён 200 мл 3,5%-ного раствора соляной кислоты ( ρ = 1,05 г/мл). Определите массовую долю хлорида аммония в образовавшемся растворе.
40
При сгорании 4,48 л (н.у.) газообразного органического вещества получили 35,2 г углекислого газа и 10,8 мл воды. Плотность этого вещества составляет 2,41 г/л (н.у.). Известно также, что это вещество не реагирует с аммиачным раствором оксида серебра, а при реакции его с избытком бромной воды происходит присоединение атомов брома только к вторичному атому углерода.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с избытком бромной воды.
11


 Получите свидетельство
Получите свидетельство Вход
Вход













 Единый государственный экзамен по химии (0.2 MB)
Единый государственный экзамен по химии (0.2 MB)
 0
0 1175
1175 115
115 Нравится
0
Нравится
0


