Сразу проверим правильность выполнения домашнего задания:
Упр 86.
А сейчас давай рассмотрим тему “Массовая доля элемента в сложном веществе”.
Во-первых, запомним, что массовая доля элемента в соединении – это отношение массы элемента к соответствующей массе соединения. Для чего её нужно знать?
Массовая доля элемента в сложном веществе, например, позволяет вносить на поле нужное количество удобрений или рассчитать выход металла из его руды, т.е. имеет практические применение. Обратим внимание на бутылку с уксусом, принесенную из магазина. На этикетке написано 9%. Что это означает? И как было определено?
Во-вторых, массовую долю элемента в соединении обозначают буквой W («дабл-ю») или ω («омега»).
Рассмотрим пример: рассчитаем массовую долю Гидрогена и Оксигена в соединении H2O. Алгоритм расчетов будет таким:
прежде всего нужно определить относительную молекулярную массу вещества.
Mr (H20)=2·1+16=18
В 18 единицах массы воды будет содержаться 2 единицы массы элемента Гидрогена и 16 единиц массы элемента Оксигена.

Чтобы определить массовую долю Гидрогена поступаем так: массу, приходящуюся на элемент Гидроген, нужно разделить на общую массу вещества. Ответ получим в частях от единицы.
W (H) = 2/18 = 0,111
Чтобы получить ответ в процентах, нужно полученное число умножить на 100%
W (H) = 2/18 = 0,111 * 100% = 11,1%
Массовая доля элемента Оксигена ищется аналогично. W(H)= 16/18×100%=88,9%.
Еще один пример. Найти массовую долю элементов в метане CH4.
Mr (CH4) = 12 + 4 × 1 = 16
W (C) = 12/16 × 100% = 75%
W (H) = 4/16 × 100% = 25%
W(O) в первом примере и W(H) во втором примере можно посчитать еще и так:
W(O) = 100% - 11,1% = 88,9%
W(H) = 100% - 75% = 25%
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход



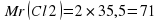
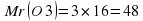
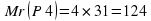
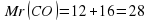
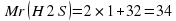
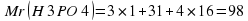
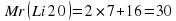
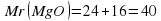
 ×1)+32=68
×1)+32=68 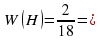 0,111
0,111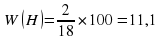
 Массовая доля элемента Оксигена ищется аналогично. W(H)= 16/18×100%=88,9%.
Массовая доля элемента Оксигена ищется аналогично. W(H)= 16/18×100%=88,9%.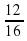 × 100% = 75 %
× 100% = 75 %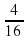 × 100% = 25 %
× 100% = 25 %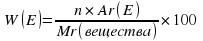
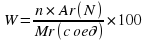
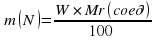
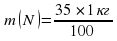 =0,35 × 1 кг= 0,35 кг, или 350 г
=0,35 × 1 кг= 0,35 кг, или 350 г








 Дистанционный материал по химии на тему "Первоначальные химические понятия" (часть 8) (23.53 КB)
Дистанционный материал по химии на тему "Первоначальные химические понятия" (часть 8) (23.53 КB)
 0
0 477
477 13
13 Нравится
0
Нравится
0


