Проверка д/з:
Упр. 161.
FeO, Mr(FeO) = 56+16=72
ω(Fe) = 56/72*100% = 77,8%
Fe2O3, Mr (Fe2O3) = 2*56+3*16=112+48=160.
ω(Fe) = 112/160*100% = 70%.
Сегодняшнее занятие у нас с тобой будет заключительным. Давай попробуем все ранее изученное еще раз разложить по полочкам. Начнем с самого начала. Вспомним, что такое химия. Определение нужно помнить наизусть.
Постарайся вспомнить о том, как возникла и развивалась наука химия. Затем не поленись повторить правила безопасной работы в химическом кабинете. Из темы: ”Первоначальные химические понятия” нужно знать определения веществам. Если забыл, то обратись к словарику химических терминов в учебнике на странице 129-131.
Каждое вещество характеризует набор физических свойств. Вещества бывают чистыми и в смеси. Смеси отличаются по свойствам от тех веществ, из которых они состоят. Например, азот имеет плотность 1,25 кг/м3, кислород 1,43 кг/м3, а воздух – смесь, состоящая в основном из этих газов – имеет плотность 1,29 кг/м3. Способы разделения однородных и неоднородных смесей постарайся запомнить.
Далее. Вещества могут быть молекулярного (т.е. состоящего из молекул) и немолекулярного (состоящего из атомов или ионов) строения. Вода – пример вещества молекулярного строения (состоит из молекул H2O)
Алмаз – вещество немолекулярного строения (состоит из атомов Карбона). Поваренная соль – вещество немолекулярного строения (состоит из ионов Na+ и Cl-)
Нужно помнить, что ионы – это атомы химических элементов, потерявшие (катионы) или принявшие (анионы) несколько электронов. А химический элемент – это определенный сорт атомов. Например, самые легкие атомы называются атомами элемента Гидрогена.

У каждого химического элемента свое название (смотри “Периодическую систему элементов”) и своя масса. Массу атомов химических элементов мы используем не истинную (абсолютную) в известных нам массовых единицах (н-р, граммах), а относительную (по отношению к условной единице, за которую принята 1/12 массы часть массы атома Карбона).
Если известны относительные атомные массы химических элементов, то не трудно подсчитать и относительные массы молекул веществ, если известны их формулы. Для этого складываем относительные атомные массы всех атомов каждого химического элемента, входящего в состав вещества.
Умея подсчитывать относительные молекулярные (формульные) массы веществ, не сложно определить массовую долю каждого элемента в составе вещества (еще раз посмотри проверку домашнего задания – упр. 161).
А вот формулы веществ составляют в соответствии с валентностью каждого химического элемента, входящего в состав вещества. Определение понятия “валентность” запомни. Далее нужно помнить, что явления, происходящие с веществами, бывают физическими и химическими. При физических явлениях состав у веществ не меняется, а при химических явлениях происходят изменения в составе веществ, т.е. происходит химическая реакция, когда одни вещества превращаются в другие.
Нужно помнить, что превращение одних веществ в другие соответствует закону сохранения массы веществ, открытому М.В. Ломоносовым. Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ.
В соответствии с этим законом в химии составляют уравнения химических реакций, при составлении уравнений химических реакций всегда нужно помнить, что количество атомов каждого химического элемента слева и справа в уравнении должно совпадать.
Нужно уметь правильно подсчитывать количество атомов элемента, исходя из индексов в формуле вещества и коэффициентов перед формулой вещества в уравнении.
И еще один важный момент. Вещества бывают простыми и сложными. В курсе 7 класса ты также ознакомился с представителем группы неметаллов – Оксигеном и представителем группы металлов – Феррумом. Особенности простых веществ, образованных этими элементами, ты изучил в учебнике в §16-21. Повтори их еще раз. Сложные вещества, образованные этими элементами, ты будешь изучать в старших классах.
И напоследок. Если хочешь знать химию, то добросовестно работай над каждой изучаемой темой. Ищи дополнительную информацию в доступных тебе справочных материалах и интернете.
P.S. Я очень хотела тебе помочь в это непростое время усвоить материал по химии за 7 класс. Если тебе понравились мои пояснения – скачай их и сохрани на будущее. Возможно в старших классах тебе придется их снова перечитать. Спасибо тебе за то, что в меру своих сил и способностей, ты учил очень интересный и важный предмет в школе – химию. Удачи тебе в будущем.
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход



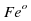 , у
, у 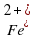 электронов (26-2=24)
электронов (26-2=24)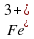 электронов (26-3=23)
электронов (26-3=23)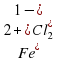 и
и 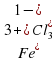
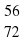 *100% = 77,8%
*100% = 77,8%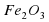 Mr(
Mr(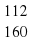 *100% = 70%
*100% = 70%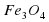 Mr(
Mr(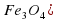 = 3*56+4*16=168+64=232
= 3*56+4*16=168+64=232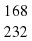 *100% = 72,4%
*100% = 72,4%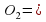 2
2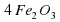 +Fe = 3
+Fe = 3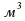 , кислород 1,43 кг/
, кислород 1,43 кг/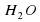 ).
). и
и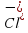 ). Нужно помнить, что ионы – это атомы химических элементов, потерявшие (катионы) или принявшие (анионы) несколько электронов. А химический элемент – это определенный сорт атомов. Например, самые легкие атомы называются атомами элемента Гидрогена. У каждого химического элемента свое название (смотри “Периодическую систему элементов”) и своя масса. Массу атомов химических элементов мы используем не истинную (абсолютную) в известных нам массовых единицах (н-р, граммах), а относительную (по отношению к условной единице, за которую принята
). Нужно помнить, что ионы – это атомы химических элементов, потерявшие (катионы) или принявшие (анионы) несколько электронов. А химический элемент – это определенный сорт атомов. Например, самые легкие атомы называются атомами элемента Гидрогена. У каждого химического элемента свое название (смотри “Периодическую систему элементов”) и своя масса. Массу атомов химических элементов мы используем не истинную (абсолютную) в известных нам массовых единицах (н-р, граммах), а относительную (по отношению к условной единице, за которую принята 








 Дистанционный материал по химии на тему "Первоначальные химические понятия" (часть 14) (20.95 КB)
Дистанционный материал по химии на тему "Первоначальные химические понятия" (часть 14) (20.95 КB)
 0
0 492
492 17
17 Нравится
0
Нравится
0


