Проверка д/з.
Дано:
m(серы)=64 г
m(ZnS)=194 г
m(Zn)-?
Решение.
Zn+S=ZnS
хг 64г 194г
X=194-64=130 г
Ответ: масса цинка равна 130г.
А сегодня мы поговорим о химических уравнениях.
К сожалению, некоторые учащиеся, даже заканчивая 11 класс, не умеют правильно составлять уравнения химических реакций (или не умеют правильно составлять формулы веществ согласно валентности элементов, либо не умеют проставлять коэффициенты в уравнениях химических реакций).
Начнем все по порядку. На прошлом занятии я объяснила тебе суть закона сохранения массы веществ при химической реакции. Из закона следует, что при химических реакциях вещества никуда не исчезают и ниоткуда не появляются. В ходе химической реакции происходит перегруппировка атомов, количество же атомов до реакции и после реакции не меняется. Это и нужно иметь ввиду.
Например, водород взаимодействует с кислородом с образованием воды.
Составим схему: Н2+О2→Н2О2.
До стрелки в схеме пишутся формулы исходных веществ, а после стрелки – формулы продуктов реакции.
До стрелки – это левая часть схемы, после стрелки–правая часть.
Слева в схеме мы видим два атома Гидрогена и два атома Оксигена, а справа– два атома Гидрогена и один атом Оксигена. Получается, что закон сохранения массы веществ не выполняется. Так ли это?
В схеме количество атомов одного и другого химического элемента до и после реакции должно быть одинаковым. Помогает уравнять количества атомов слева и справа следующее рассуждение: Н2+О2→Н2О2.
Атомов Оксигена справа должно быть 2, перед формулой Н2О2 поставим число (оно называется коэффициентом), равное 2.
Н2+О2→2Н2О2
Теперь справа записаны две молекулы воды, в которых два атома Оксигена и четыре атома Гидрогена, а слева только два атома Гидрогена. Чтобы их уравнять слева и справа, поставим перед Н2 коэффициент 2. Получим 2Н2+О2→2Н2О2.
Количества атомов Гидрогена и Оксигена слева и справа в схеме одинаково.
Вместо стрелки имеем право поставить знак равенства как в любом математическом уравнении, где левая и правая часть уравнения равны.
2Н2+О2=2Н2О2
Рассмотрим еще один пример.

Р+О2→Р2О5
Слева атом Фосфора один, а справа их два. Слева перед P поставим 2.
2P+О2→Р2О5
Количества атомов Фосфора слева и справа одинаково. А вот количество атомов Оксигена разное. Слева их два, а справа – пять. Попробуем их уравнять. Перед О2 поставим коэффициент 5, а перед Р2О5 поставим коэффициент 2.
2P+5О2→2Р2О5
Атомов Оксигена слева десять и справа тоже десять, но зато теперь разнится количество атомов Фосфора. Слева их два, а справа 4, поэтому поставленный ранее коэффициент 2 перед P зачеркиваем и заменяем на 4.
4P+5О2→2Р2О5
4P+5О2=2Р2О5
В дальнейшем ты научишься подбирать коэффициенты в уме, и тебе не придется зачеркивать цифры в уравнении. При расстановке коэффициентов нужно помнить, что если у тебя перед каждым веществом имеются коэффициенты, которые можно сократить на одно и то же число, то мы это и сделаем. Например, мы могли проставить такие коэффициенты
8P+10О2=4Р2О5
Количества атомов слева и справа тоже одинаковы, но их можно сократить на 2. Получим
4P+5О2=2Р2О5
Еще пример.
Al+HCl→AlHCl3+Н2
Атомов Алюминия слева и справа по одному. Гидроген слева один, а справа их два. Атомов Хлора слева один, а справа их три. Ставим коэффициенты так:
Al + 3HCl→AlHCl3 + Н2
Теперь атомов Гидрогена слева три, а справа – 2. Поставим коэффициенты так:
Al + 6HCl→2AlHCl3 + Н2
Атомов Гидрогена слева и справа поровну. Атомов Хлора слева и справа поровну, а вот атом Алюминия слева один, а справа их два.
Расставим коэффициенты таким образом:
2Al + 6HCl→2AlHCl3 + 3Н2
2Al + 6HCl=2AlHCl3 + 3Н2
Домашнее задание:
Выполнить упражнение 106 и 107 учебника на странице 91.

 Получите свидетельство
Получите свидетельство Вход
Вход



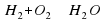
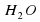 поставим число (оно называется коэффициентом), равное 2.
поставим число (оно называется коэффициентом), равное 2.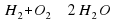
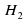 коэффициент 2. Получим 2
коэффициент 2. Получим 2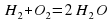
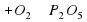
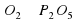
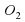 поставим коэффициент 5, а перед
поставим коэффициент 5, а перед 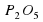 поставим коэффициент 2.
поставим коэффициент 2.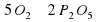
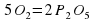
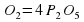
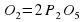

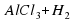
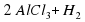
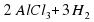









 Дистанционный материал по химии на тему "Первоначальные химические понятия" (часть 11) (26.82 КB)
Дистанционный материал по химии на тему "Первоначальные химические понятия" (часть 11) (26.82 КB)
 0
0 349
349 16
16 Нравится
0
Нравится
0


