Тип урока: постановка и решение учебных задач.
Метод обучения: проблемный.
Формы работы учащихся: фронтальная, парная и индивидуальная, групповая.
Задачи урока:
образовательная: создание условий для высокого уровня воспроизведения знаний и умений ;
развивающая: создание условий для поиска взаимосвязи между новым и изученным материалом, развитие логического мышления, умения приобретать знания не заучиванием, а рассуждением;
воспитательная: создание условий для формирования культуры умственного и практического труда,.
Демонстрационный эксперимент и оборудование к нему:
- Изучение отличительных свойств чистых веществ и смесей (лабораторный штатив с кольцами, два сосуда с дистиллированной и солёной (морской) водой, термометр, спиртовка, стеклянная палочка).
- Разделение смеси фильтрованием (лабораторный штатив с кольцом, воронка, фильтровальная бумага, стеклянная палочка, стакан химический).
- Разделение смеси выпариванием (раствор поваренной соли, лабораторный штатив с кольцом, фарфоровая чашка (выпарительная), спиртовка, тигельные щипцы, стеклянная палочка).
Ход урока:
I. Организационный момент
II. Актуализация знаний, постановка проблемы
- Что называют веществом? (Вещество – это то, из чего состоят физические тела)
- Что понимают, по-вашему, под понятием «чистое вещество»? Чем отличается чистое вещество от смеси веществ?
III.Объяснение нового материала
- Смеси и их классификация.
В природе вещества встречаются не абсолютно чистые, а преимущественно в виде смесей.
Ученикам предлагается рассмотреть смеси, находящиеся на демонстрационном столе (раствор поваренной соли в воде, смесь железных и древесных опилок, смесь воды и растительного масла). Рассказывается о воздухе, как смеси, которая состоит из газов – азота, кислорода, углекислого газа, аргона и пр.. Приводятся и другие виды смесей (см. Таблица 1):
Таблица 1. Примеры смесей веществ по агрегатным состояниям составляющих компонентов – смотрите документ.
Далее рассматривается классификация смесей по однородности (Таблица 2).
Таблица 2. Классификация смесей веществ по их однородности – смотрите документ.
Для научных исследований и промышленности, в основном требуются чистые вещества. Некоторые примеси даже в небольших количествах способны сильно поменять свойства веществ. Например, в полупроводниковой технике применяют сверхчистые вещества, где примеси составляют всего 1 атом на миллион атомов основного элемента (Si, Ge). Превышение нормы ведет к резкому ухудшению полупроводниковых свойств этих веществ. В то же время необходимо выделить, что невозможно получить абсолютно чистое вещество, т.к. любое чистое вещество содержит хотя бы ничтожное малое количество примесей.
- Чистое вещество.
Ученикам демонстрируется эксперимент: в двух сосудах нагревают до кипения дистиллированную и солёную (морскую) воду. Через определенное время измеряют температуры кипения в этих сосудах. Ученики обсуждают результаты эксперимента. Учитель обозначает проблему: «Почему у морской воды, по сравнению с дистиллированной, tкип не постоянная в разные промежутки времени? Учащиеся делают вывод, что соленость морской воды влияет на температуру кипения. С помощью учителя формулируется определение «Чистым веществом называется такое вещество, у которого постоянные физические свойства (температуры кипения, температуры плавления, плотность). Примером чистого вещества может случить дистиллированная вода.
- Основные способы разделения смеси
Демонстрация способов разделения смесей (см. рисунки 1,2, 3,4):
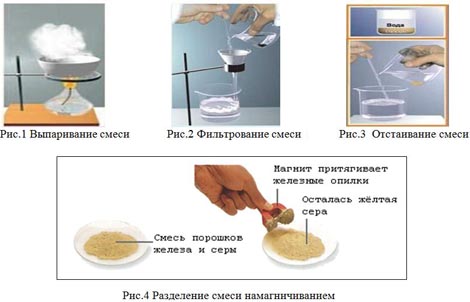
Учащиеся приходят к выводу, что способы разделения смесей основаны на различных свойствах веществ, входящих в их состав (см.Таблицу 3):
Таблица 3. Способы разделения смесей (с зависимости от свойств веществ-компонентов) – смотрите документ
IV. Закрепление материала.
Групповая работа (5-10 минут). Класс делится на 3 группы. Каждая группа получает задание:
Предложите план разделения смеси веществ, опираясь на их свойства.
1 группа: «Разделение неоднородной смеси железа и серы». (Примерный ответ: смесь железа и серы - неоднородная; её можно разделить с помощью магнита, т.к. железо намагничивается, а сера нет. Также эту смесь можно разделить отстаиванием (если дополнительно растворить в воде), т.к. сера и железо - твёрдые вещества не растворимые в воде. Если высыпать эту смесь в воду - сера всплывёт на поверхность, а железо утонет)
2 группа: «Разделение неоднородной смеси речного песка с водой». (Примерный ответ: смесь песка с водой - неоднородная смесь, её можно разделить фильтрованием).
3 группа: «Разделение однородной смеси сульфата меди (II) с водой».(Примерный ответ: предложен раствор соли голубого цвета в воде - это однородная смесь; её можно разделить выпариванием).
На втором этапе обучающимся было предложено ответить на вопросы:
Перед вами названия различных химических систем. Выберите из них чистые вещества.
Дистиллированная вода, морская вода, кислород, серебро, гранит, сталь, раствор хлорида натрия для инъекций, водород, чугун, углекислый газ, воздух, базальт, стекло, эмульсия «масло в воде», свинец.
Также был предложен проверочный тест по теме "Чистые вещества и смеси. Способы разделения смесей" (см. Приложение 1)
V. Подведение итогов. Рефлексия
Что нового вы узнали сегодня на уроке?
Что запомнилось?
Что понравилось, а что не удалось, на ваш взгляд?
Самостоятельно определите свою оценку по проделанной ими работе.
VI. Домашнее задание.

 Получите свидетельство
Получите свидетельство Вход
Вход















 Чистые вещества и смеси. Способы разделения смесей (0.18 MB)
Чистые вещества и смеси. Способы разделения смесей (0.18 MB)
 0
0 3696
3696 844
844 Нравится
0
Нравится
0


