
Қарағанды «Болашақ» маңызды білім беретін колледжі Қарағанды «Болашақ» маңызды білім беретін колледжі
- Колледждің әдістемелік тақырыбы: «Оқыту процесіне заманауи және ақпараттық технологияларды кіріктіру арқылы тұлғаның кәсіби және әлеуметтік құзыреттілігін қалыптастыру»
- Пән : «Химия»
- Орындаған: Жаркимбекова А.Т
Сутек, оттек, хлор, күкірт, азот, көміртектің қасиеттері.

Сабақтың мақсаты мен міндеті
А) білімділік : Бейметалдардың периодтық жүйедегі орны, атом құрылысының ерекшеліктері, физикалық және химиялық қасиеттерін оқып үйрену.
Б) дамытушылық : Жоспар бойынша, оқулықпен жұмыс істеу машығын қалыптастырып, өз бетінше шешім шығара білу қабілетін жетілдіру.
В)тәрбиелілік: Ой еңбегінің мәдениетін қалыптастырып және тәртіп пен жауапкершілікке тәрбиелеу.
Д.И. Менделеевтің периодтық кестесі
Элементтер топтары
Период
VIII
VI
I
II
III
IV
V
VII
Н
Не
1
1
2
1,00797
4.0026
Водород
Гелий
Ве
F
В
С
N
О
Li
Nе
7
9
6
10
8
3
5
4
2
14,0067
15,9994
12,01115
10,811
18,9984
20,183
6.939
9,0122
Бор
Фтор
Неон
Углерод
Кислород
Бериллий
Азот
Литий
P
Мg
Cl
Al
Si
S
Na
Ar
17
14
11
12
13
17
15
3
18
28,086
32,064
35,453
30,9738
26,9815
24,312
22,9898
39,948
Натрий
Фосфор
Алюминий
Сера
Хлор
Магний
Кремний
Аргон
28
Sc
22
25
Ti
Мn
21
V
Сa
Cr
27
Со
24
Fe
26
К
23
Ni
20
19
4
44,956
58,9332
50,942
51,996
55,847
58,71
47,90
44,956
40,08
39,102
Титан
Марганец
Железо
Никель
Скандий
Калий
Кальций
Кобальт
Ванадий
Хром
Сu
29
30
Se
Zn
As
Br
Ge
Ga
Кr
31
35
33
32
34
36
63,546
65,37
79,904
78,96
74,9216
26,9815
72,59
83,80
Медь
Цинк
Германий
Мышьяк
Бром
Галлий
Селен
Криптон
44
40
41
Nb
39
Zr
Y
Sr
46
Pd
Rb
Мо
43
Rh
Тс
45
42
Ru
38
37
5
101,07
[ 99]
102,905
91,22
95,94
106,4
88,905
92,906
85,47
87,62
Палладий
Стронций
Рубидий
Цирконий
Родий
Технеций
Молибден
Ниобий
Рутений
Иттрий
Тe
Sb
48
Сd
47
Ag
In
I
Sn
Xe
50
51
52
53
49
54
112,40
107,868
114,82
126,9044
78,96
121,75
118,69
131,30
Серебро
Сурьма
Олово
Теллур
Кадмий
Индий
Йод
Ксенон
57
Оs
Hf
72
La
Та
Cs
Ва
Рt
77
Ir
73
Re
78
75
76
W
74
55
56
*
6
186,2
195,09
178.49
180,948
190,2
183.85
138,81
192,2
137.34
132,905
Осмий
Рений
Цезий
Гафний
Платина
Вольфрам
Барий
Иридий
Тантал
Лантан
80
Ро
Вi
Pb
Hg
At
79
Аu
ТI
Rn
82
85
83
84
81
86
196,967
200,59
204,37
210
[ 210]
207,19
208,980
[ 222]
Свинец
Висмут
Полоний
Золото
Ртуть
Астат
Таллий
Радон
Мt
Rа
Hs
108
107
Db
105
106
Fr
Bh
Ас
89
Rf
Sg
109
104
87
88
**
7
[ 263]
[ 261 ]
[ 266]
[ 265]
[ 226]
[ 262]
[ 223]
138,81
[ 262]
Резерфордий
Борий
Дубний
Мейтнерий
Хассий
Сиборгий
Радий
Актиний
Франций
RO
RO 4
R 2 O 7
RO 3
R 2 O 5
RO 2
R 2 O 3
жоғарғы
R 2 О
оксидтер
RH 4
RH 3
RH 2
RH
ЖСҚ
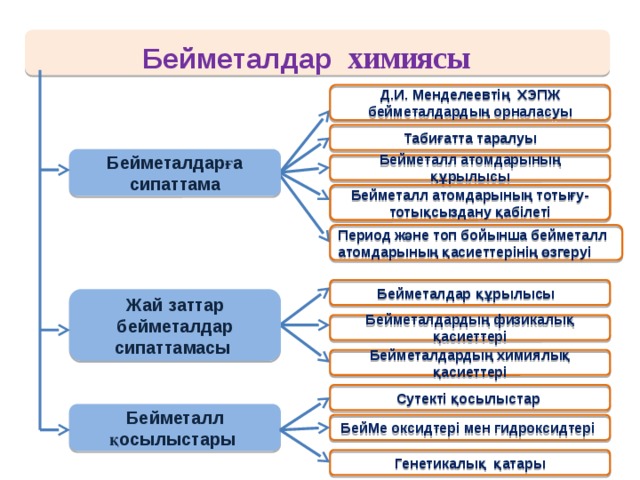
Бейметалдар химиясы
Д.И. Менделеевтің ХЭПЖ бейметалдардың орналасуы
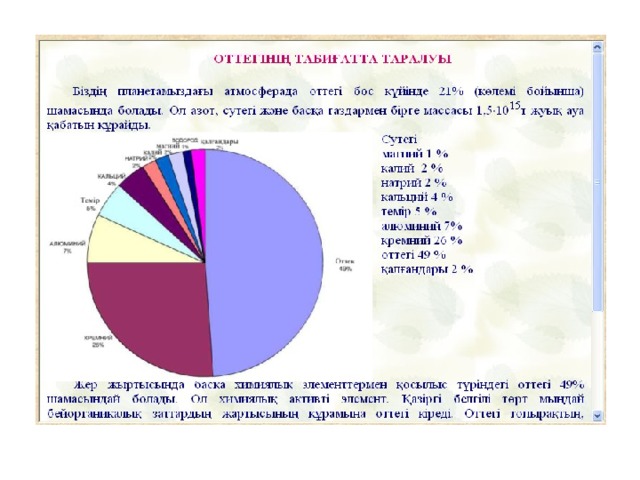
Табиғатта таралуы
Бейметалдарға сипаттама
Бейметалл атомдарының құрылысы
Бейметалл атомдарының тотығу-тотықсыздану қабілеті
Период және топ бойынша бейметалл атомдарының қасиеттерінің өзгеруі
Бейметалдар құрылысы
Жай заттар бейметалдар сипаттамасы
Бейметалдардың физикалық қасиеттері
Бейметалдардың химиялық қасиеттері
Сутекті қосылыстар
Бейметалл қосылыстары
БейМе оксидтері мен гидроксидтері
Генетикалық қатары
4
![Периоды период қатар Д.И. Менделеевтің периодтық жүйесіндегі орны Элемент топтары VI V III IV VIII VII I II 1 2 Н 1 He 1 (H) 1,00797 4,0026 Водород Гелий 6 5 9 7 8 10 Ne O N С В 2 F 2 15,9994 14,0067 10,811 20,163 12,0112 18,9984 Бор Азот Фтор Неон Кислород Углерод 15 16 17 14 18 3 Ar 3 Si S Р Cl 35,453 39,948 32,064 28,086 30,9738 Кремний Хлор Фосфор Аргон Сера 4 4 33 35 34 36 Д.И.Менделеевтің ХЭПЖ металдарды бейметалдардан негізгі топша элементтері: B; Si; As; Te; At бөліп көрсетуге болады. Бейметалдар шекарадан жоғары орналасады. Kr As Br Se 5 83,80 78,96 79,904 74,9216 Криптон Мышьяк Бром Селен 5 6 52 53 54 Xe 7 Te I 131,30 127,60 126,904 Ксенон Теллур Иод 8 6 85 86 Rn At 9 [222] 210 Радон Астат 7 10 Жоғарғы оксидтері RO 2 RO 4 RO 3 R 2 O 5 R 2 O RO R 2 O 7 R 2 O 3 RH 4 RH 3 H 2 R ЖСҚ HR](https://fsd.videouroki.net/html/2018/05/23/v_5b05a85e61c3b/img5.jpg)
Периоды
период
қатар
Д.И. Менделеевтің периодтық жүйесіндегі орны
Элемент топтары
VI
V
III
IV
VIII
VII
I
II
1
2
Н
1
He
1
(H)
1,00797
4,0026
Водород
Гелий
6
5
9
7
8
10
Ne
O
N
С
В
2
F
2
15,9994
14,0067
10,811
20,163
12,0112
18,9984
Бор
Азот
Фтор
Неон
Кислород
Углерод
15
16
17
14
18
3
Ar
3
Si
S
Р
Cl
35,453
39,948
32,064
28,086
30,9738
Кремний
Хлор
Фосфор
Аргон
Сера
4
4
33
35
34
36
Д.И.Менделеевтің ХЭПЖ металдарды бейметалдардан негізгі топша элементтері: B; Si; As; Te; At бөліп көрсетуге болады. Бейметалдар шекарадан жоғары орналасады.
Kr
As
Br
Se
5
83,80
78,96
79,904
74,9216
Криптон
Мышьяк
Бром
Селен
5
6
52
53
54
Xe
7
Te
I
131,30
127,60
126,904
Ксенон
Теллур
Иод
8
6
85
86
Rn
At
9
[222]
210
Радон
Астат
7
10
Жоғарғы оксидтері
RO 2
RO 4
RO 3
R 2 O 5
R 2 O
RO
R 2 O 7
R 2 O 3
RH 4
RH 3
H 2 R
ЖСҚ
HR

Белгілі 109 элементтің 22-сі бейметалдарға жатады. Бейметалдар топырақ массасының 84%-ін, өсімдік массасының 98,5% -ін,және адам денесі массасының 97,5%-ін құрайды.
Көміртек, сутек, азот, фосфор, күкірт органогенді элементтер болып табылады. Өйткені олар белок, май, көмірсулар және нуклеин қышқылдары молекулаларының құрамына кіреді. Біз демалатын ауа бейметалдардан түзілетін жай заттардың қоспасы болып табылады.

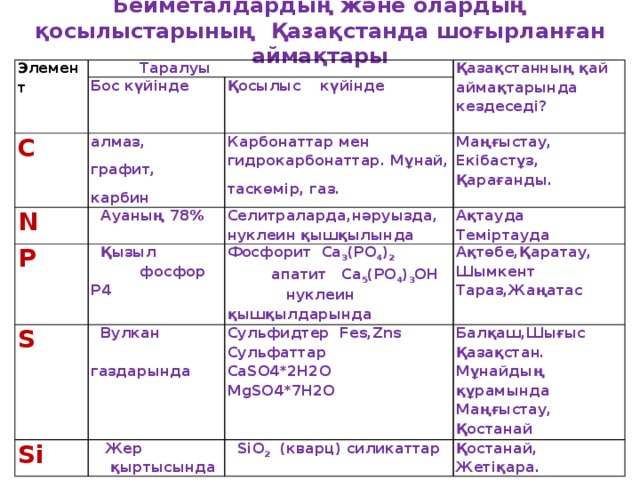
Бейметалдардың және олардың қосылыстарының Қазақстанда шоғырланған аймақтары
Элемент
Таралуы
Бос күйінде
C
N
Қазақстанның қай аймақтарында кездеседі?
Қосылыс күйінде
алмаз,
P
Ауаның 78%
графит,
Карбонаттар мен гидрокарбонаттар. Мұнай,
таскөмір, газ.
карбин
Селитраларда,нәруызда, нуклеин қышқылында
Қызыл фосфор Р4
Маңғыстау, Екібастұз, Қарағанды.
S
Ақтауда Теміртауда
Фосфорит Ca 3 (PO 4 ) 2 апатит Ca 5 (PO 4 ) 3 OH нуклеин қышқылдарында
Вулкан газдарында
Si
Ақтөбе,Қаратау, Шымкент Тараз,Жаңатас
Сульфидтер Fes,Zns Сульфаттар CaSO4*2H2O MgSO4*7H2O
Жер қыртысында
Балқаш,Шығыс Қазақстан. Мұнайдың құрамында Маңғыстау, Қостанай
SiO 2 (кварц) силикаттар
Қостанай, Жетіқара.

Ашылу тарихы
Хлорды тұз қышқылының марганец екі тотығына әсерін зерттей отырып
1774 жылы Карл Шееле ашқан. Хлор атауы 1812 жылы ұсынылды. Хлор атомы фтор атомына қарағанда үлкен электрон санына, үлкен радиусқа ие және бос d- орбиталі бар. Барлық осы ерекшеліктер осы элементтің химиясына ерекшелік енгізеді, бірақта хлор мен фтор арасындағы ұқсастық хлор мен бром арасындағы ұқсастыққа қарағанда жақсырақ көрінеді.

Хлордың алыну жолы
2KMnO 4 + 16HCl = 2KCl + MnCl 2 + 5Cl 2 + H 2 O
MnO 2 + 4HCl = Cl 2 + MnCl 2 + H 2 O

Ашылу тарихы
Оттегі XVII ғ. 70-ші жылдары бір уақытта тіпті бір-біріне тәуелсіз үш зерттеушілермен ашылған: Д.Пристлей, оны сынап оксидін қыздыру арқылы үлкен линза фокусіне жиналған күн сәулесінің көмегімен алған (1770 ж.), К.Шееле, магний нитраты, селитра және басқадай заттардың ыдырауымен (1772 ж.), және А.Лавуазье (1774-1775жж.) ашқан. Француздардың oxygene және латындардың oxygenium грек тілінен аударғанда: «оксос»- қышқыл және «геннао»-тудырамын деген мағына білдіреді.
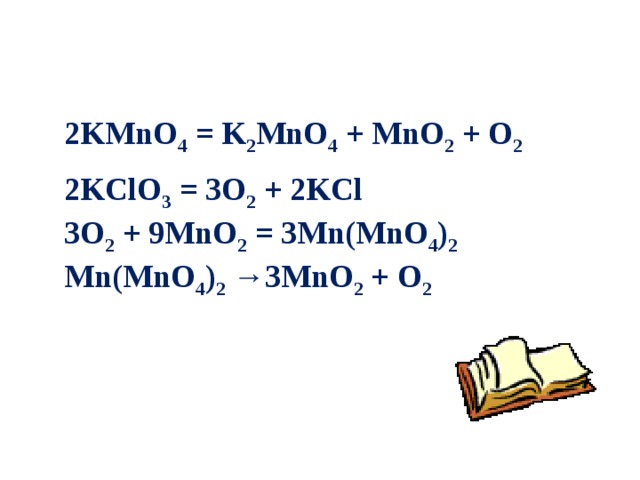
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2
2KClO 3 = 3O 2 + 2KCl
3O 2 + 9MnO 2 = 3Mn(MnO 4 ) 2
Mn(MnO 4 ) 2 →3MnO 2 + O 2

Ашылу тарихы
Азотты 1772 жылы ағылшын химигі Д. Блэктің шәкірті Д. Рутерфорд ашты. Сол жылы азотты ауадан ағылшын химигі – Г. Кавендиш, сол сияты К. Шееле бөліп алған. «Азот» деген атауды Париж ғылыми Академиясының номенклатуралық комиссиясы ұсынған. Байқауымызша бұл сөз негізінде барлық бардың «бастауы және аяғы» деген мағына беруі тиіс және үш алфавиттің – латын, грек,ежелгі еврейдің бастапқы және соңғы әріптерінен құралған: а- альфа, алеф –зет, омега –,яғни «аазот» (азот). Азоттың латындық атауы «нитрогениум».
(NН 4 ) 2 Cr 2 O 7 → N 2 +4H 2 O + Cr 2 O 3

Ашылу тарихы
Фосфорды ең алғаш 1669 жылы алхимик Бранд несеп нәрін айдаудан қалған қалдықтық құрыштау арқылы алды. «Фосфор» сөзі грекше жарық «тасымалдаушы» деген мағына береді.;
фосфорды алғашқы зерттеушілерді оның қараңғыда жарық беруі таң
қалдырды.
Ca 3 (PO 4 ) 2 + 3SiO 2 + 5C → 5CO + 3CaSiO 3 + 2P

Ашылу тарихы
Сутек (Hudrogenium) XVI ғасырдың бірінші жартысында неміс дәрігері және жаратылыстанушысы Парацельс ашты. 1766 жылы ағылшын ғалымы К.Кавендиш оның қасиеттерін дәлелдеп, басқа газдардан айырмашылығын көрсетті. Сутектің үш түрлі изотопы бар, протий 1 Н, дейтерий 2 Н немесе D, тритий 3 Н бар. Олардың массалық саны 1,2 және 3 тең. Протий мен дейтерий тұрақты, тритий – радиоактивті (ыдырау периоды 12,5 жылға созылады). Табиғатта дейтерий және протий қосылыстарының орташа қатынасы 1:6800 (атом санына бойынша). Тритий өте аз мөлшерде кездеседі.
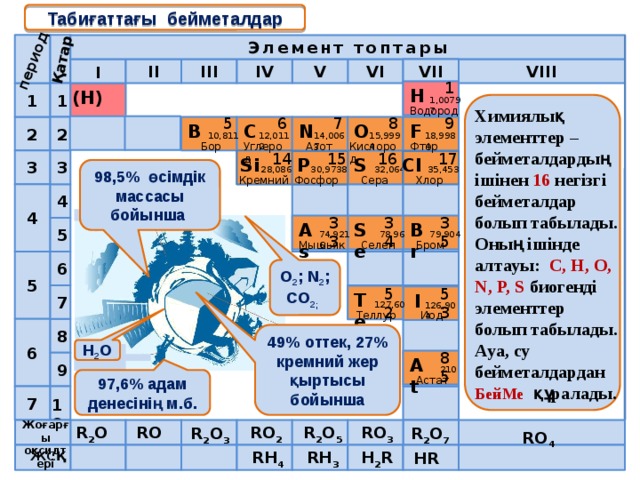
Периоды
период
Қатар
Табиғаттағы бейметалдар
Элемент топтары
VI
V
III
IV
VIII
VII
I
II
1
Н
1
1
(H)
1,00797
Водород
Химиялық элементтер –бейметалдардың ішінен 16 негізгі бейметалдар болып табылады. Оның ішінде алтауы: С, Н, О, N, P, S биогенді элементтер болып табылады. Ауа, су бейметалдардан БейМе құралады.
8
6
5
9
7
С
В
F
2
2
O
N
14,0067
10,811
12,0112
18,9984
15,9994
Азот
Кислород
Бор
Фтор
Углерод
16
17
15
14
3
3
Si
Р
Cl
S
98,5% өсімдік массасы бойынша
32,064
30,9738
28,086
35,453
Хлор
Кремний
Фосфор
Сера
4
4
34
35
33
Br
As
Se
5
78,96
79,904
74,9216
Бром
Мышьяк
Селен
6
5
O 2 ; N 2 ; CO 2;
52
53
7
Te
I
127,60
126,904
Теллур
Иод
8
6
49% оттек, 27% кремний жер қыртысы бойынша
Н 2 О
85
At
9
210
Астат
97,6% адам денесінің м.б.
7
10
Жоғарғы оксидтері
R 2 O 5
RO 3
R 2 O
RO 2
RO
R 2 O 3
R 2 O 7
RO 4
RH 4
H 2 R
RH 3
ЖСҚ
HR
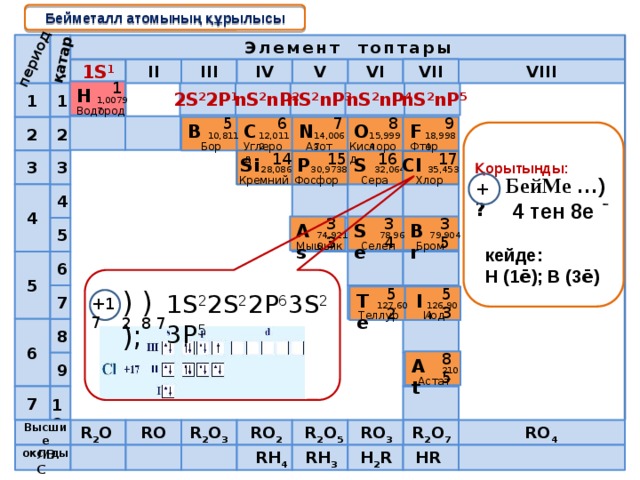
Периоды
период
қатар
Бейметалл атомының құрылысы
Элемент топтары
1S 1
II
VI
V
III
VII
IV
VIII
1
Н
1
1
nS 2 nP 4
nS 2 nP 5
nS 2 nP 3
2S 2 2P 1
nS 2 nP 2
1,00797
Водород
6
9
8
7
5
F
С
N
2
В
O
2
15,9994
14,0067
12,0112
18,9984
10,811
Қорытынды:
Бор
Кислород
Фтор
Углерод
Азот
15
16
14
17
3
3
Cl
Si
S
Р
28,086
30,9738
35,453
32,064
БейМе …)
4 тен 8e
Фосфор
Сера
Хлор
Кремний
+?
4
4
35
34
33
Br
Se
As
5
78,96
79,904
74,9216
Бром
Селен
Мышьяк
кейде:
Н (1 ē ); В (3 ē )
5
6
) ) );
53
52
1S 2 2S 2 2P 6 3S 2 3P 5
7
I
Te
+17
127,60
126,904
Иод
Теллур
2 8 7
8
6
85
At
9
210
Астат
7
10
Высшие оксиды
R 2 O
RO
RO 2
R 2 O 3
R 2 O 5
RO 3
R 2 O 7
RO 4
ЛВС
RH 4
RH 3
HR
H 2 R
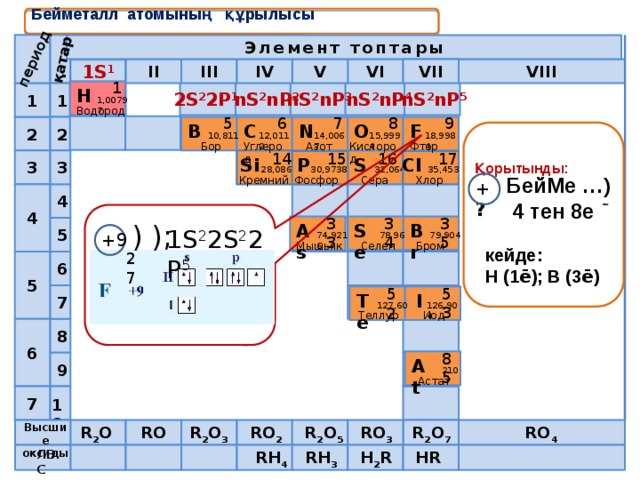
Бейметалл атомының құрылысы
Периоды
период
қатар
Элемент топтары
1S 1
V
III
IV
VIII
VI
II
VII
1
Н
1
1
nS 2 nP 5
nS 2 nP 4
2S 2 2P 1
nS 2 nP 3
nS 2 nP 2
1,00797
Водород
5
6
7
9
8
2
В
O
2
N
С
F
18,9984
15,9994
12,0112
10,811
14,0067
Қорытынды:
Бор
Углерод
Азот
Кислород
Фтор
14
16
15
17
3
3
Si
Р
Cl
S
30,9738
32,064
28,086
35,453
БейМе …)
4 тен 8e
Фосфор
Кремний
Хлор
Сера
+?
4
4
34
35
33
) );
Se
Br
As
5
1S 2 2S 2 2P 5
+9
79,904
78,96
74,9216
Бром
Селен
Мышьяк
кейде:
Н (1 ē ); В (3 ē )
2 7
5
6
53
52
7
I
Te
127,60
126,904
Иод
Теллур
8
6
85
At
9
210
Астат
7
10
Высшие оксиды
RO 4
R 2 O 7
RO 3
R 2 O 5
RO 2
R 2 O 3
RO
R 2 O
ЛВС
H 2 R
HR
RH 4
RH 3
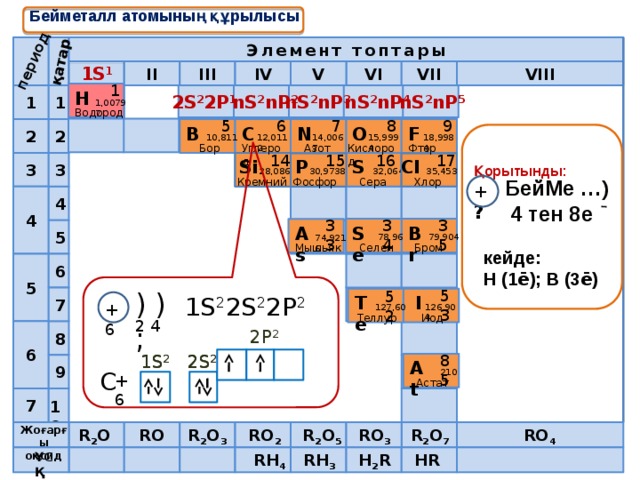
Периоды
период
қатар
Бейметалл атомының құрылысы
Элемент топтары
1S 1
VI
V
III
IV
II
VIII
VII
1
Н
1
1
nS 2 nP 5
nS 2 nP 4
nS 2 nP 3
nS 2 nP 2
2S 2 2P 1
1,00797
Водород
9
6
5
8
7
В
2
С
F
N
2
O
15,9994
18,9984
12,0112
14,0067
10,811
Қорытынды:
Фтор
Кислород
Бор
Азот
Углерод
14
16
15
17
Si
S
Р
3
3
Cl
28,086
30,9738
32,064
35,453
БейМе …)
4 тен 8e
Хлор
Сера
Фосфор
Кремний
+?
4
4
35
34
33
Br
Se
As
5
78,96
79,904
74,9216
Селен
Бром
Мышьяк
кейде:
Н (1 ē ); В (3 ē )
5
6
53
) );
52
1S 2 2S 2 2P 2
7
I
Te
+6
127,60
126,904
Иод
Теллур
2 4
8
6
2P 2
85
1S 2
1S 2
2S 2
2S 2
At
9
C
210
+6
Астат
7
10
Жоғарғы оксид
RO 3
R 2 O 7
R 2 O 3
R 2 O 5
RO 2
RO
R 2 O
RO 4
ҰСҚ
HR
H 2 R
RH 3
RH 4
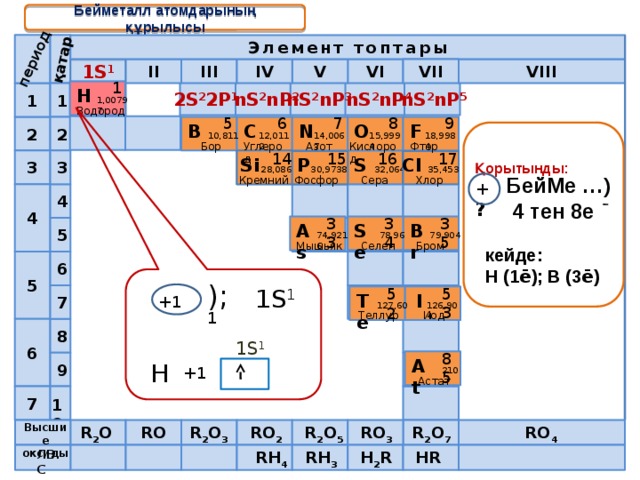
Периоды
период
қатар
Бейметалл атомдарының құрылысы
Элемент топтары
1S 1
V
III
IV
VIII
VI
II
VII
1
Н
1
1
nS 2 nP 5
nS 2 nP 4
2S 2 2P 1
nS 2 nP 3
nS 2 nP 2
1,00797
Водород
5
6
7
9
8
2
В
O
2
N
С
F
18,9984
15,9994
12,0112
10,811
14,0067
Қорытынды:
Бор
Углерод
Азот
Фтор
Кислород
14
16
15
17
3
3
Si
Р
S
Cl
28,086
35,453
32,064
30,9738
БейМе …)
4 тен 8e
Сера
Кремний
Фосфор
Хлор
+?
4
4
34
35
33
Br
Se
As
5
78,96
79,904
74,9216
Селен
Бром
Мышьяк
кейде:
Н (1 ē ); В (3 ē )
5
6
);
1S 1
53
52
7
Te
I
+1
126,904
127,60
1
Теллур
Иод
6
8
1S 1
85
At
9
Н
+1
210
Астат
7
10
Высшие оксиды
RO 4
R 2 O 3
RO 3
R 2 O
RO
RO 2
R 2 O 5
R 2 O 7
ЛВС
RH 3
H 2 R
HR
RH 4
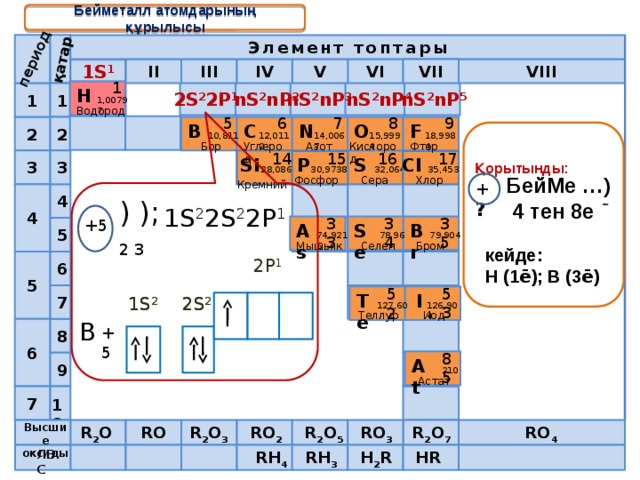
Периоды
период
қатар
Бейметалл атомдарының құрылысы
Элемент топтары
1S 1
III
IV
VIII
V
VI
VII
II
1
Н
1
1
nS 2 nP 5
2S 2 2P 1
nS 2 nP 2
nS 2 nP 3
nS 2 nP 4
1,00797
Водород
8
7
5
6
9
N
С
2
2
O
В
F
10,811
12,0112
18,9984
15,9994
14,0067
Қорытынды:
Углерод
Фтор
Бор
Азот
Кислород
17
16
14
15
Cl
3
3
S
Si
Р
30,9738
28,086
32,064
35,453
БейМе …)
4 тен 8e
Сера
Фосфор
Хлор
+?
Кремний
4
4
) );
1S 2 2S 2 2P 1
35
34
33
+5
Se
Br
As
5
78,96
79,904
74,9216
Селен
Бром
Мышьяк
2 3
кейде:
Н (1 ē ); В (3 ē )
2P 1
6
5
53
52
7
Te
I
2S 2
1S 2
2S 2
1S 2
127,60
126,904
Теллур
Иод
В
6
8
+5
85
At
9
210
Астат
7
10
Высшие оксиды
R 2 O
RO
R 2 O 3
RO 2
RO 3
R 2 O 7
RO 4
R 2 O 5
ЛВС
RH 4
RH 3
H 2 R
HR
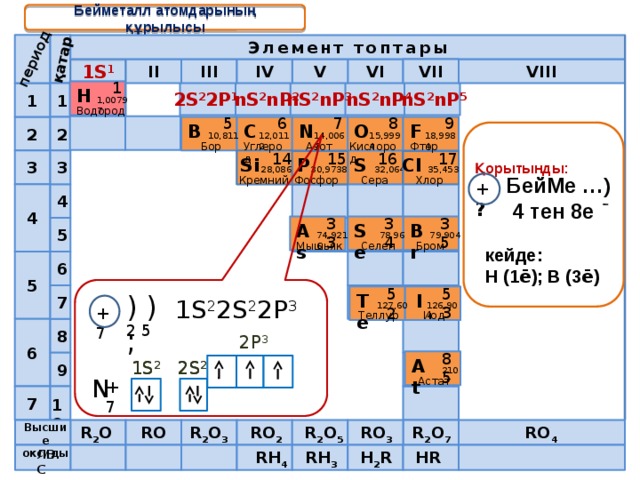
Периоды
период
қатар
Бейметалл атомдарының құрылысы
Элемент топтары
1S 1
III
IV
V
VI
VIII
VII
II
1
Н
1
1
2S 2 2P 1
nS 2 nP 2
nS 2 nP 3
nS 2 nP 4
nS 2 nP 5
1,00797
Водород
9
5
6
7
8
В
С
N
2
2
F
O
15,9994
14,0067
10,811
12,0112
18,9984
Қорытынды:
Кислород
Азот
Углерод
Бор
Фтор
16
15
17
14
S
3
Si
Р
Cl
3
30,9738
28,086
35,453
32,064
БейМе …)
4 тен 8e
Сера
Фосфор
Хлор
Кремний
+?
4
4
35
34
33
Se
Br
As
5
78,96
79,904
74,9216
Бром
Селен
Мышьяк
кейде:
Н (1 ē ); В (3 ē )
5
6
53
52
7
) );
Te
I
1S 2 2S 2 2P 3
127,60
126,904
+7
Теллур
Иод
2 5
6
8
2P 3
85
At
9
1S 2
1S 2
2S 2
2S 2
210
N
Астат
+7
7
10
Высшие оксиды
RO 2
R 2 O 3
RO 3
R 2 O 7
RO 4
R 2 O 5
RO
R 2 O
ЛВС
RH 4
RH 3
H 2 R
HR
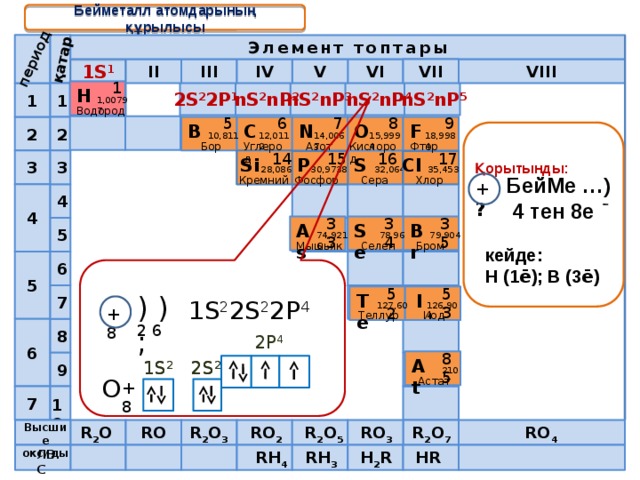
Периоды
период
қатар
Бейметалл атомдарының құрылысы
Элемент топтары
1S 1
VI
II
III
IV
VIII
V
VII
1
Н
1
1
nS 2 nP 2
nS 2 nP 5
2S 2 2P 1
nS 2 nP 4
nS 2 nP 3
1,00797
Водород
9
8
7
6
5
O
F
В
2
С
N
2
10,811
15,9994
14,0067
12,0112
18,9984
Қорытынды:
Фтор
Кислород
Азот
Углерод
Бор
14
15
16
17
3
Р
S
3
Cl
Si
32,064
30,9738
35,453
28,086
БейМе …)
4 тен 8e
Сера
Хлор
Кремний
Фосфор
+?
4
4
34
35
33
Se
Br
As
5
79,904
78,96
74,9216
Бром
Селен
Мышьяк
кейде:
Н (1 ē ); В (3 ē )
5
6
53
52
7
) );
Te
I
1S 2 2S 2 2P 4
127,60
126,904
+8
Теллур
Иод
2 6
8
6
2P 4
85
At
9
1S 2
2S 2
2S 2
1S 2
210
O
Астат
+8
7
10
Высшие оксиды
R 2 O 3
RO 2
R 2 O 5
RO 3
R 2 O 7
RO 4
R 2 O
RO
ЛВС
RH 3
RH 4
HR
H 2 R
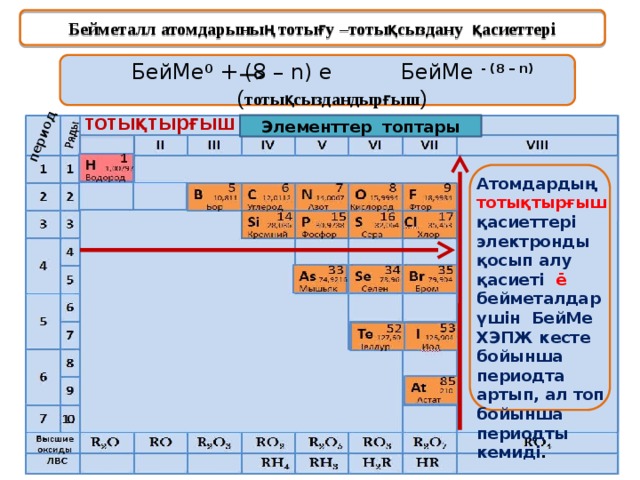
период
Бейметалл атомдарының тотығу –тотықсыздану қасиеттері
БейМе 0 + (8 – n) e БейМе - (8 – n) ( тотықсыздандырғыш )
тотықтырғыш
Элеме
Элементтер топтары
Атомдардың тотықтырғыш қасиеттері электронды қосып алу қасиеті ē бейметалдар үшін БейМе ХЭПЖ кесте бойынша периодта артып, ал топ бойынша периодты кемиді .
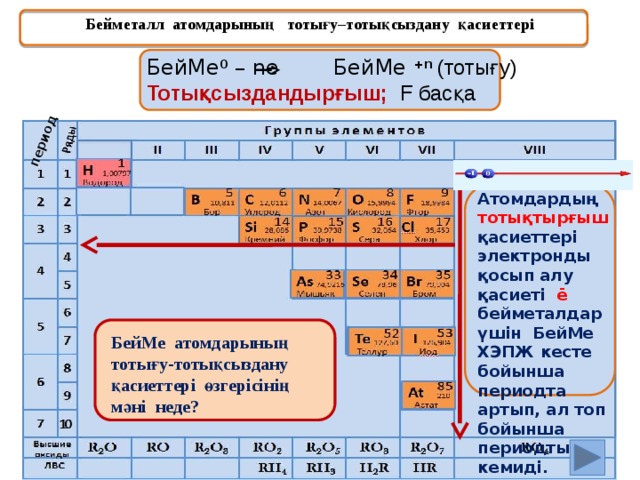
период
Бейметалл атомдарының тотығу–тотықсыздану қасиеттері
БейМе 0 – ne БейМе +n (тотығу)
Тотықсыздандырғыш; F басқа
Атомдардың тотықтырғыш қасиеттері электронды қосып алу қасиеті ē бейметалдар үшін БейМе ХЭПЖ кесте бойынша периодта артып, ал топ бойынша периодты кемиді.
БейМе атомдарының тотығу-тотықсыздану қасиеттері өзгерісінің мәні неде?
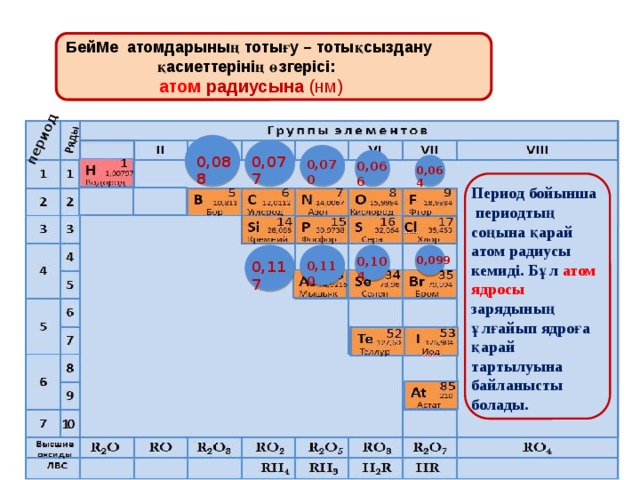
период
БейМе атомдарының тотығу – тотықсыздану қасиеттерінің өзгерісі:
атом радиусына (нм)
0,088
0,077
0,070
0,066
0,064
Период бойынша периодтың соңына қарай атом радиусы кемиді. Бұл атом ядросы зарядының ұлғайып ядроға қарай тартылуына байланысты болады.
0,104
0,099
0,117
0,110
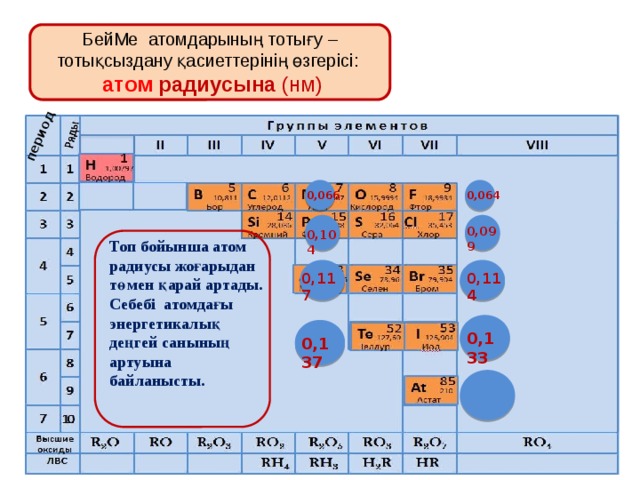
период
БейМе атомдарының тотығу – тотықсыздану қасиеттерінің өзгерісі:
атом радиусына (нм)
0,064
0,066
0,099
0,104
Топ бойынша атом радиусы жоғарыдан төмен қарай артады. Себебі атомдағы энергетикалық деңгей санының артуына байланысты.
0,114
0,117
0,133
0,137
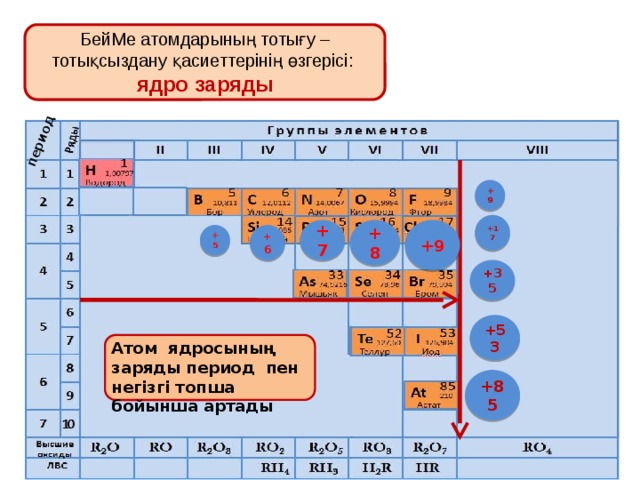
период
БейМе атомдарының тотығу – тотықсыздану қасиеттерінің өзгерісі:
ядро заряды
+9
+17
+9
+8
+7
+6
+5
+35
+53
Атом ядросының заряды период пен негізгі топша бойынша артады
+85
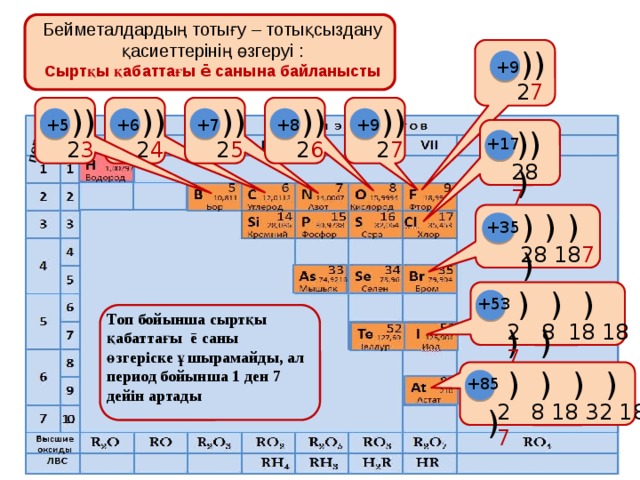
период
Бейметалдардың тотығу – тотықсыздану қасиеттерінің өзгеруі :
Сыртқы қабаттағы ē санына байланысты
))
+9
2 7
))
))
))
))
))
+7
+8
+6
+5
+9
)))
+17
2 7
2 6
2 5
2 4
2 3
28 7
) ) ) )
+35
28 18 7
) ) ) ) )
+53
Топ бойынша сыртқы қабаттағы ē саны өзгеріске ұшырамайды, ал период бойынша 1 ден 7 дейін артады
2 8 18 18 7
) ) ) ) ) )
+85
2 8 18 32 18 7
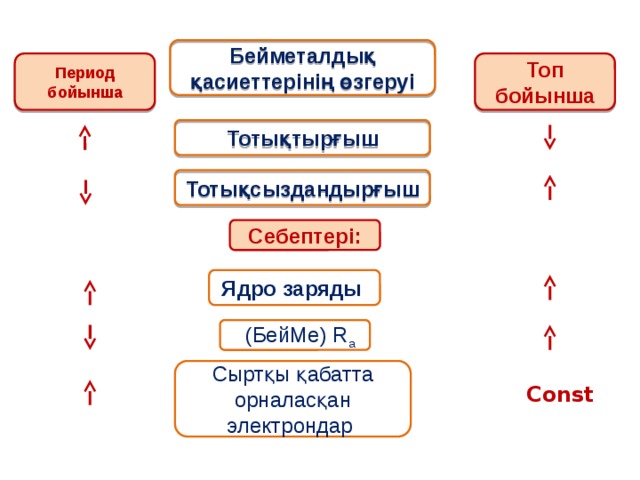
Бейметалдық қасиеттерінің өзгеруі
Период бойынша
Топ бойынша
Тотықтырғыш
Тотықсыздандырғыш
Себептері:
Ядро заряды
(БейМе) R a
Сыртқы қабатта орналасқан электрондар
Const
![Құрылысы БейМе (Асыл газдар) Кристалдық тор атомдық [С] n ,[Si] n , [S] n Ковалентті полюссіз байланыс H H : Аллотропия көміртек ( графит ) кремний ¨ ¨ O O : : ¨ Молекулалық кристалдық тор ¨ (Н 2 , О 2 , N 2 , F 2 ) ¨ ¨ N N ¨ ¨ ¨ бром йод](https://fsd.videouroki.net/html/2018/05/23/v_5b05a85e61c3b/img31.jpg)
Құрылысы
БейМе
(Асыл газдар)
Кристалдық тор атомдық
[С] n ,[Si] n , [S] n
Ковалентті полюссіз байланыс
H
H
:
Аллотропия
көміртек ( графит )
кремний
¨
¨
O
O
:
:
¨
Молекулалық кристалдық тор
¨
(Н 2 , О 2 , N 2 , F 2 )
¨
¨
N
N
¨
¨
¨
бром
йод
![Аллотропиясы қызыл сары ақ озон оттек [Р] n [Р] n [Р] 4 [О] n графит алмаз фуллерен [С] n](https://fsd.videouroki.net/html/2018/05/23/v_5b05a85e61c3b/img32.jpg)
Аллотропиясы
қызыл
сары
ақ
озон
оттек
[Р] n
[Р] n
[Р] 4
[О] n
графит
алмаз
фуллерен
[С] n
 Tº балқу Tº қайнау Н 2 О летучие Ц Йод возгонкасы Br 2 ? Молекулалық кристалл тор нашар Tº балқу Tº қайнау Н 2 О Электр тогы мен жылуды өте нашар өткізеді " width="640"
Tº балқу Tº қайнау Н 2 О летучие Ц Йод возгонкасы Br 2 ? Молекулалық кристалл тор нашар Tº балқу Tº қайнау Н 2 О Электр тогы мен жылуды өте нашар өткізеді " width="640"
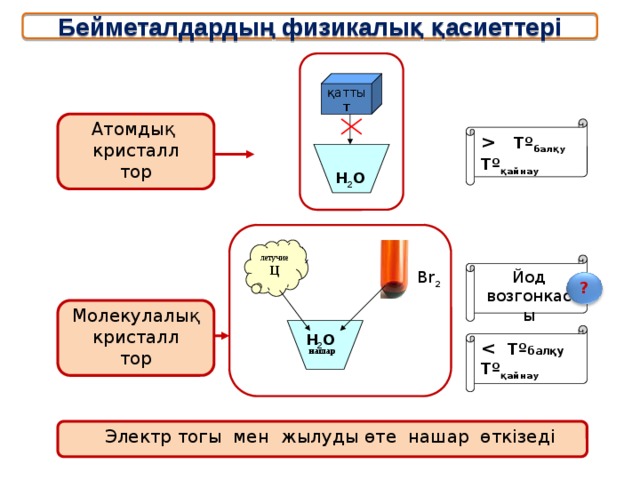
Бейметалдардың физикалық қасиеттері
қатты
т
Атомдық
кристалл
тор
Tº балқу Tº қайнау
Н 2 О
летучие Ц
Йод
возгонкасы
Br 2
?
Молекулалық
кристалл
тор
нашар
Tº балқу Tº қайнау
Н 2 О
Электр тогы мен жылуды өте нашар өткізеді
Бейметалдардың химиялық қасиеттері
Ме
Cl 2 0 +Na 0 →
Cl 2 0 +P 0 →
БейМе
БейМе 0
тотықтырғыш
+
тұз
Cl 2 0 +NaI →
БейМе оксиді (тотықсыз -ш)
Cl 2 0 +CO →
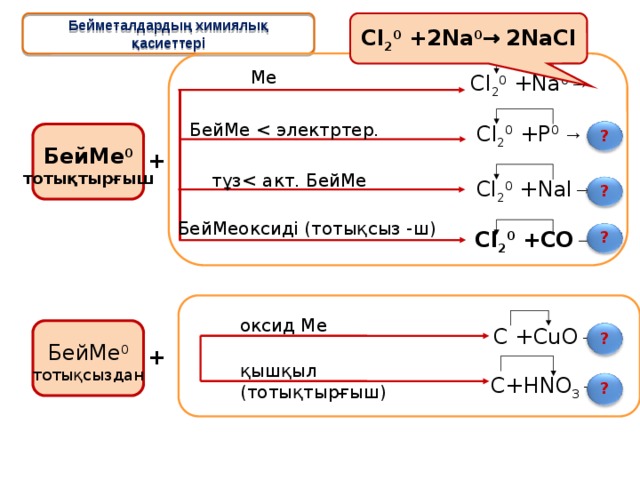
Cl 2 0 +2Na 0 → 2 NaCl
Бейметалдардың химиялық қасиеттері
Ме
Cl 2 0 +Na 0 →
Cl 2 0 +P 0 →
БейМе
?
БейМе 0
тотықтырғыш
+
тұз
Cl 2 0 +NaI →
?
БейМеоксиді (тотықсыз -ш)
Cl 2 0 +CO →
?
оксид Ме
C +CuO →
?
БейМе 0
тотықсыздан
+
қышқыл (тотықтырғыш)
C+HNO 3 →
?
Cl 2 0 +2Na 0 → 2 NaCl
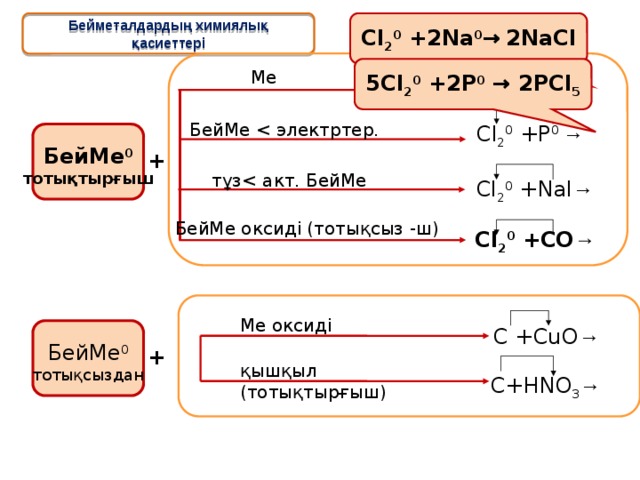
Бейметалдардың химиялық қасиеттері
5Cl 2 0 +2P 0 → 2PCl 5
Ме
Cl 2 0 +Na 0 →
БейМе
Cl 2 0 +P 0 →
БейМе 0
тотықтырғыш
+
тұз
Cl 2 0 +NaI →
БейМе оксиді (тотықсыз -ш)
Cl 2 0 +CO →
Ме оксиді
C +CuO →
БейМе 0
тотықсыздан
+
қышқыл (тотықтырғыш)
C+HNO 3 →
Cl 2 0 +2Na 0 → 2 NaCl
Бейметалдардың химиялық қасиеттері
5Cl 2 0 +2P 0 → 2PCl 5
Ме
Cl 2 0 +Na 0 →
?
Cl 2 0 +2NaI→2NaCl+I 2
Cl 2 0 +P 0 →
БейМе
?
БейМе 0
тотықтырғыш
+
тұз
Cl 2 0 +NaI →
?
БейМе оксиді (тотықсыз -ш)
Cl 2 0 +CO →
?
Ме оксиді
C +CuO →
?
БейМе 0
тотықсыздан
+
қышқыл (тотықтырғыш)
C+HNO 3 →
?
Cl 2 0 +2Na 0 → 2 NaCl
Бейметалдардың химиялық қасиеттері
5Cl 2 0 +2P 0 → 2PCl 5
Ме
Cl 2 0 +Na 0 →
?
Cl 2 0 +2NaI→2NaCl+I 2
Cl 2 0 +P 0 →
БейМе
?
БейМе 0
тотықтырғыш
+
Cl 2 0 + CO→ COCl 2
фосген
тұз
Cl 2 0 +NaI →
?
БейМе оксиді (тотықсыз -ш)
Cl 2 0 +CO →
?
Ме оксиді
C +CuO →
?
БейМе 0
тотықсыздан
+
қышқыл (тотықтырғыш)
C+HNO 3 →
?
Cl 2 0 +2Na 0 → 2 NaCl
Бейметалдардың химиялық қасиеттері
5Cl 2 0 +2P 0 → 2PCl 5
Ме
Cl 2 0 +Na 0 →
?
Cl 2 0 +2NaI→2NaCl+I 2
Cl 2 0 +P 0 →
БейМе
?
БейМе 0
тотықтырғыш
+
Cl 2 0 + CO→ COCl 2
фосген
тұз
Cl 2 0 +NaI →
?
БейМе оксиді (тотықсыз -ш)
Cl 2 0 +CO →
?
C + CuO → Cu + CO
Ме оксиді
C +CuO →
?
БейМе 0
тотықсыздан
+
қышқыл (тотықтырғыш)
C+HNO 3 →
?
Cl 2 0 +2Na 0 → 2 NaCl
Бейметалдардың химиялық қасиеттері
5Cl 2 0 +2P 0 → 2PCl 5
Ме
Cl 2 0 +Na 0 →
?
Cl 2 0 +2NaI→2NaCl+I 2
БейМе
Cl 2 0 +P 0 →
?
БейМе 0
тотықтырғыш
+
Cl 2 0 + CO→ COCl 2
фосген
тұз
Cl 2 0 +NaI →
?
БейМеоксиді (тотықсыз -ш)
Cl 2 0 +CO →
?
C + CuO → Cu + CO
оксид Ме
S + HNO 3 → H 2 SO 4 + NO 2 + H 2 O
Электронды баланс әдістері арқылы теңестіріңдер
C +CuO →
?
БейМе 0
тотықсыздан
+
қышқыл (тотықтырғыш)
S+HNO 3 →
?

Бейметалдардың химиялық қасиеттері
металдарды тотықтырады ( заттар электрондарын беруге немесе қосып алуға бейім):
3F 2 + 2Al = 2AlF 3
S + Fe = FeS (tº)
O 2 + 2Mg = 2MgO ( tº) 2C + Ca = CaC 2 (tº)

Бейметалдардың химиялық қасиеттері
Басқа бейметалдарды тотықтырады (электрон қосып алуға бейім):
2F 2 + C = CF 4 (tº)
S + H 2 = H 2 S (tº)
O 2 + S = SO 2 ( tº)

Бейметалдардың химиялық қасиеттері
Көптеген күрделі заттарды тотықтырады
4F 2 + CH 4 = CF 4 + 4HF
Cl 2 + 2HBr = Br 2 + 2HCl
3O 2 + 4NH 3 = 2N 2 + 6H 2 O (tº)

Бейметалдардың химиялық қасиеттері
БейМе тұздарынан белсенділігі анағұрлым жоғары болса, ығыстырып шығарады:
Hal 2 + F 2 = 2НаlF
Наl = Сl, Вr, I
Cl 2 + 2NaBr = Br 2 + 2NaCl

Бейметалдардың химиялық қасиеттері
( графит пен сутек тотықсыздандырғыш қасиет көрсетеді )
2С + MnO 2 = Mn + 2CO
4H 2 + Fe 3 O 4 = 3Fe + 4H 2 O

Бейметалдардың химиялық қасиеттері
Электртерістілігі жоғары бейметалдармен тотықсыздандырғыш ретінде әрекеттеседі:
Si + 2F 2 = SiF 4
C + O 2 = CO 2
C + 2S = CS 2

Бейметалдардың химиялық қасиеттері
Өздігінен жүретін тотығу-тотықсыздану реакциясына қатысады
Сl 2 + Н 2 О = НСl + НСlO - 25 кД ж .
Сілті қатысында жүретін тотығу-тотықсыздану реакциясына қатысады
Сl 2 + 2NаОН = NаСl + NаСlO + Н 2 О
( суықта )
ЗСl 2 + 6КОН = 2КСl + КClO 3 + ЗН 2 О
(қыздырғанда)
 Tºбалқу Tºқайнау Бейметалдардың химиялық қасиеттері Тотықсыздандырғыш БейМе тотықс Тотықтырғыш БейМе тотық Ме оксиді Ме БейМе қышқыл (тотықтырғыш) тұзӨздігінен тотығу - тотықсыздану Бей оксиді (тотықсызд) " width="640"
Tºбалқу Tºқайнау Бейметалдардың химиялық қасиеттері Тотықсыздандырғыш БейМе тотықс Тотықтырғыш БейМе тотық Ме оксиді Ме БейМе қышқыл (тотықтырғыш) тұзӨздігінен тотығу - тотықсыздану Бей оксиді (тотықсызд) " width="640"
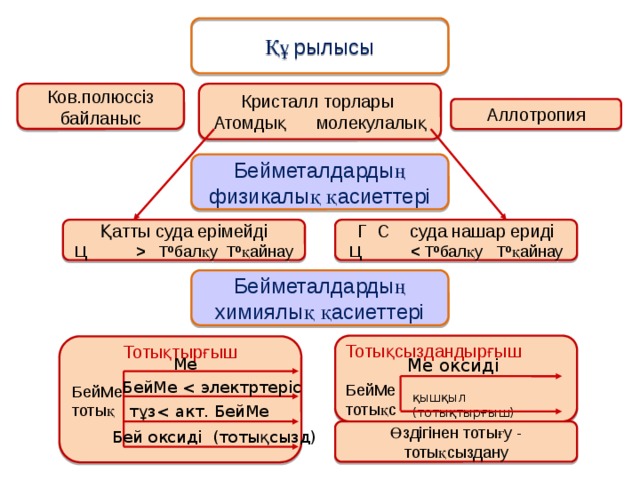
Құрылысы
Ков.полюссіз байланыс
Кристалл торлары
Атомдық молекулалық
Аллотропия
Бейметалдардың физикалық қасиеттері
Қатты суда ерімейді
Г С суда нашар ериді
Ц Tºбалқу Tºқайнау
Ц Tºбалқу Tºқайнау
Бейметалдардың химиялық қасиеттері
Тотықсыздандырғыш
БейМе
тотықс
Тотықтырғыш
БейМе
тотық
Ме оксиді
Ме
БейМе
қышқыл (тотықтырғыш)
тұз
Өздігінен тотығу - тотықсыздану
Бей оксиді (тотықсызд)
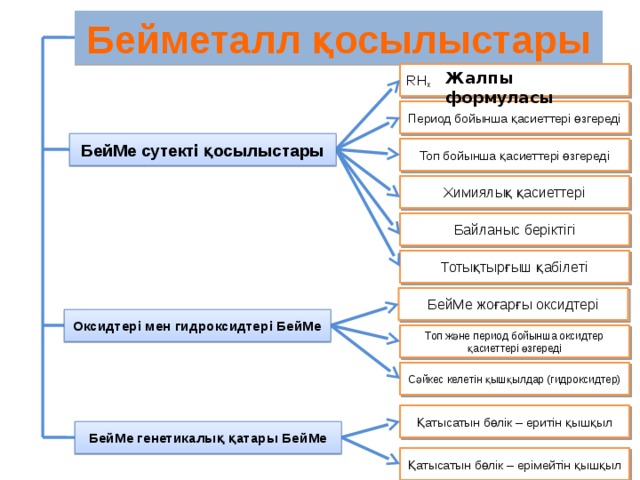
Бейметалл қосылыстары
RH x
Жалпы формуласы
Период бойынша қасиеттері өзгереді
БейМе сутекті қосылыстары
Топ бойынша қасиеттері өзгереді
Химиялық қасиеттері
Байланыс беріктігі
Тотықтырғыш қабілеті
БейМе жоғарғы оксидтері
Оксидтері мен гидроксидтері БейМе
Топ және период бойынша оксидтер қасиеттері өзгереді
Сәйкес келетін қышқылдар (гидроксидтер)
Қатысатын бөлік – еритін қышқыл
БейМе генетикалық қатары БейМе
Қатысатын бөлік – ерімейтін қышқыл
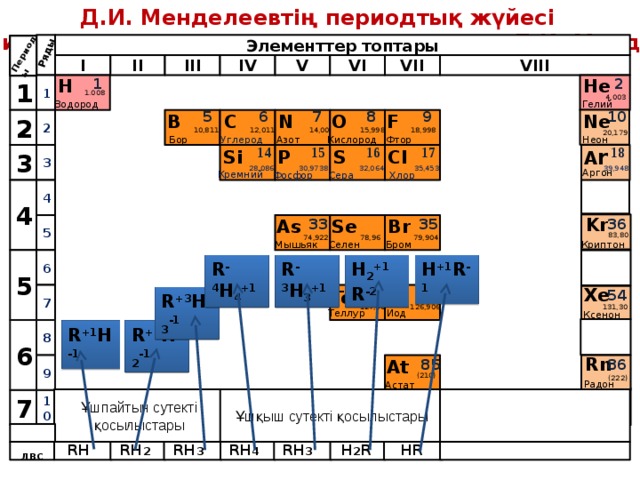
Д.И. Менделеевтің периодтық жүйесі
Периодическая система химических элементов Д.И. Менделеева
Периоды
Ряды
Элементтер топтары
VII
VIII
VI
V
IV
III
II
I
2
He
1
Н
1
1
1.008
4,003
Гелий
Водород
10
9
7
8
6
5
N
B
O
F
Ne
C
2
2
15,998
18,998
10,811
12,011
14,00
20,179
Азот
Кислород
Фтор
Бор
Неон
Углерод
18
17
14
15
16
A r
Cl
Р
Si
S
3
3
35,453
32,064
28,086
39,948
30,9738
Аргон
Кремний
Хлор
Фосфор
Сера
4
4
Kr
33
35
36
Br
Se
As
5
83,80
74,922
78,96
79,904
Селен
Мышьяк
Бром
Криптон
5
6
Н +1 R -1
Н 2 +1 R -2
R -4 Н 4 +1
R -3 Н 3 +1
Xe
Te
I
54
53
52
7
R +3 Н 3 -1
126,906
127,60
131,30
Теллур
Иод
Ксенон
8
6
R +2 Н 2 -1
R +1 Н -1
Rn
86
85
At
9
(210)
(222)
Радон
Астат
Ұшқыш сутекті қосылыстары
Ұшпайтын сутекті қосылыстары
7
10
H 2 R
RH
RH 2
RH 3
RH 3
RH 4
HR
ЛВС
52
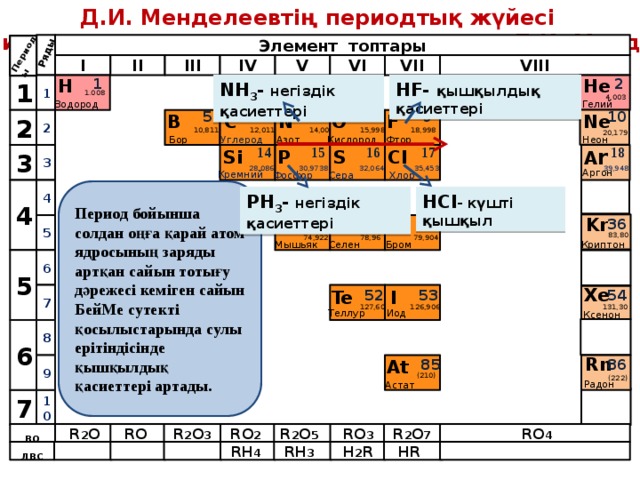
Д.И. Менделеевтің периодтық жүйесі
Периодическая система химических элементов Д.И. Менделеева
Периоды
Ряды
Элемент топтары
VII
VIII
VI
V
IV
III
II
I
1
Н
He
2
NН 3 - негіздік қасиеттері
НF- қышқылдық қасиеттері
1
1
1.008
4,003
Гелий
Водород
9
5
6
10
8
7
Ne
O
B
C
N
F
2
2
10,811
14,00
15,998
18,998
12,011
20,179
Кислород
Фтор
Азот
Углерод
Неон
Бор
15
18
17
14
16
A r
S
Si
Cl
Р
3
3
30,9738
32,064
28,086
35,453
39,948
Аргон
Фосфор
Сера
Кремний
Хлор
4
4
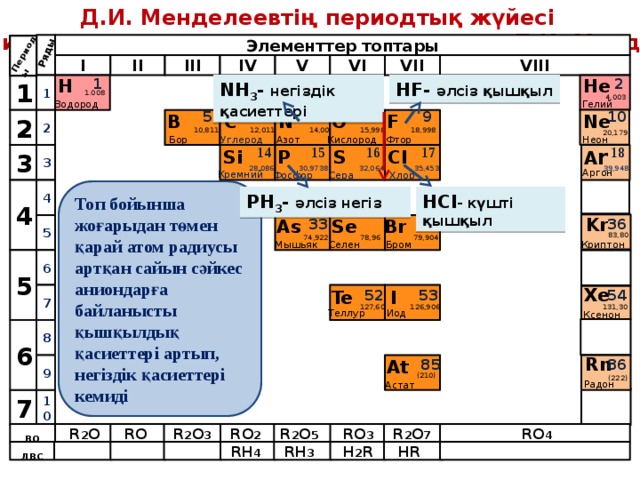
Период бойынша солдан оңға қарай атом ядросының заряды артқан сайын тотығу дәрежесі кеміген сайын БейМе сутекті қосылыстарында сулы ерітіндісінде қышқылдық қасиеттері артады.
НCl - күшті қышқыл
РН 3 - негіздік қасиеттері
Kr
36
As
Se
33
35
Br
5
83,80
79,904
78,96
74,922
Мышьяк
Селен
Криптон
Бром
5
6
Xe
54
53
52
Te
I
7
131,30
126,906
127,60
Теллур
Иод
Ксенон
8
6
Rn
At
85
86
9
(210)
(222)
Радон
Астат
7
10
RO
R 2 O
RO 4
R 2 O 7
RO 3
R 2 O 5
RO 2
R 2 O 3
ВО
RH 4
RH 3
H 2 R
HR
ЛВС
53
![: : : : : : : : Қышқылдардың суда еруі [ ] + Н : : -2 -1 -1 : : : : : : Н F О + + Н Н F Н Н O қысқартылған Н 2 О -2 Н 3 О + + НF -1 F -1 +](https://fsd.videouroki.net/html/2018/05/23/v_5b05a85e61c3b/img53.jpg)
:
:
:
:
:
:
:
:
Қышқылдардың суда еруі
[
]
+
Н
:
:
-2
-1
-1
:
:
:
:
:
:
Н
F
О
+
+
Н
Н
F
Н
Н
O
қысқартылған
Н 2 О -2
Н 3 О +
+
НF -1
F -1
+
Д.И. Менделеевтің периодтық жүйесі
Периодическая система химических элементов Д.И. Менделеева
Периоды
Ряды
Элементтер топтары
I
II
III
IV
VI
VII
VIII
V
1
Н
2
He
НF- әлсіз қышқыл
NН 3 - негіздік қасиеттері
1
1
1.008
4,003
Водород
Гелий
6
7
5
9
8
10
Ne
O
B
C
N
F
2
2
12,011
10,811
18,998
15,998
14,00
20,179
Кислород
Азот
Фтор
Углерод
Неон
Бор
16
18
14
17
15
A r
S
Si
Cl
Р
3
3
30,9738
32,064
28,086
35,453
39,948
Аргон
Фосфор
Сера
Кремний
Хлор
4
4
Топ бойынша жоғарыдан төмен қарай атом радиусы артқан сайын сәйкес аниондарға байланысты қышқылдық қасиеттері артып, негіздік қасиеттері кемиді
НCl - күшті қышқыл
РН 3 - әлсіз негіз
Kr
36
As
Se
33
35
Br
5
83,80
79,904
78,96
74,922
Мышьяк
Селен
Криптон
Бром
5
6
Xe
54
53
52
Te
I
7
131,30
126,906
127,60
Теллур
Иод
Ксенон
8
6
Rn
At
85
86
9
(210)
(222)
Радон
Астат
7
10
RO
R 2 O
RO 4
R 2 O 7
RO 3
R 2 O 5
RO 2
R 2 O 3
ВО
RH 4
RH 3
H 2 R
HR
ЛВС
55
![Аммиактың суда ерігіштігі : : : : : : : : [ ] [ ] + - Н : : -3 : : -2 : : : : О + + Н Н Н О Н Н N Н Н N Н Н Қысқартылған күйде + OH - NН 4 + Н 2 О -2 Н 3 N -3 + ? Азот атомының жұптаспаған электрон жұбы болады, ал сутек атомының - бос орбиталі болады.](https://fsd.videouroki.net/html/2018/05/23/v_5b05a85e61c3b/img55.jpg)
Аммиактың суда ерігіштігі
:
:
:
:
:
:
:
:
[
]
[
]
+
-
Н
:
:
-3
:
:
-2
:
:
:
:
О
+
+
Н
Н
Н
О
Н
Н
N
Н
Н
N
Н
Н
Қысқартылған күйде
+
OH -
NН 4 +
Н 2 О -2
Н 3 N -3
+
?
Азот атомының жұптаспаған электрон жұбы болады, ал сутек атомының - бос орбиталі болады.
Д.И. Менделеевтің периодтық жүйесі
Периодическая система химических элементов Д.И. Менделеева
Периоды
Ряды
Элементтер топтары
VII
VIII
V
VI
IV
III
II
I
2
Н
1
He
1
1
1.008
4,003
Гелий
Водород
9
5
7
8
6
10
C
B
O
N
F
Ne
2
2
14,00
12,011
10,811
18,998
15,998
20,179
Фтор
Кислород
Неон
Бор
Углерод
Азот
17
14
15
16
18
A r
Cl
Si
S
Р
3
3
30,9738
32,064
28,086
35,453
39,948
Аргон
Хлор
Фосфор
Кремний
Сера
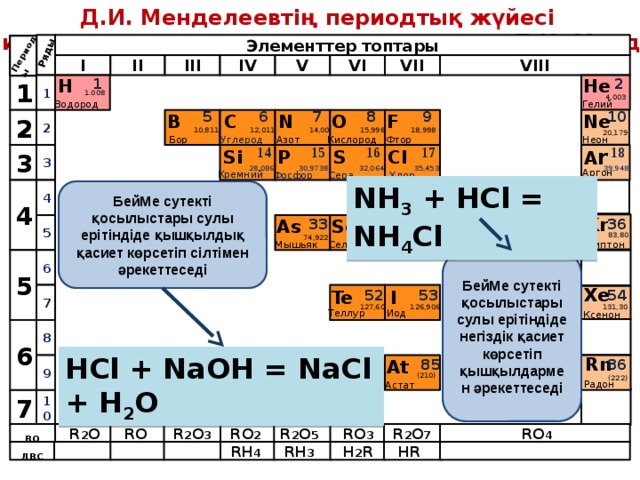
NH 3 + HCl = NH 4 Cl
4
4
БейМе сутекті қосылыстары сулы ерітіндіде қышқылдық қасиет көрсетіп сілтімен әрекеттеседі
Kr
33
36
Br
35
Se
As
5
83,80
74,922
78,96
79,904
Бром
Криптон
Селен
Мышьяк
5
6
БейМе сутекті қосылыстары сулы ерітіндіде негіздік қасиет көрсетіп қышқылдармен әрекеттеседі
Xe
53
54
52
I
Te
7
131,30
126,906
127,60
Теллур
Иод
Ксенон
6
8
HCl + NaOH = NaCl + H 2 O
Rn
At
86
85
9
(210)
(222)
Радон
Астат
7
10
R 2 O 7
RO 3
R 2 O 5
RO 2
RO 4
R 2 O 3
RO
R 2 O
ВО
RH 3
HR
H 2 R
RH 4
ЛВС
57
Д.И. Менделеевтің периодтық жүйесі
Периодическая система химических элементов Д.И. Менделеева
Периоды
Ряды
Элементтер топтары
VI
VIII
VII
IV
V
III
II
I
1
He
Н
2
1
1
1.008
4,003
Гелий
Водород
7
6
10
5
8
9
HF
Ne
N
O
B
C
F
2
2
10,811
12,011
14,00
18,998
15,998
20,179
Фтор
Кислород
Азот
Углерод
Бор
Неон
18
14
17
15
16
A r
S
Si
Cl
Р
3
3
30,9738
32,064
28,086
39,948
35,453
Аргон
Фосфор
Сера
Кремний
Хлор
HCl
4
4
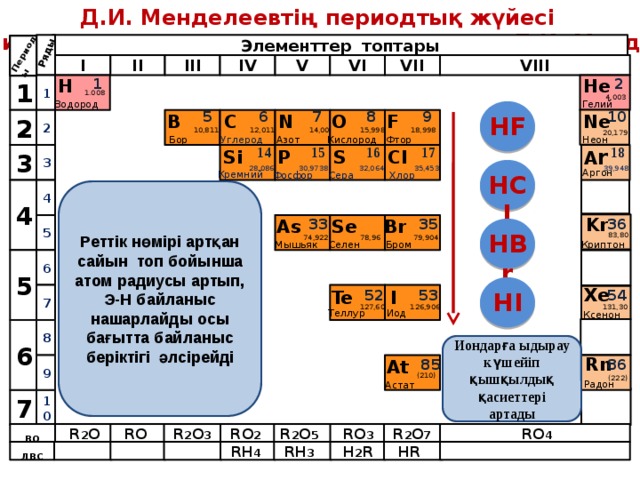
Реттік нөмірі артқан сайын топ бойынша атом радиусы артып, Э-Н байланыс нашарлайды осы бағытта байланыс беріктігі әлсірейді
Kr
Se
As
36
35
Br
33
5
HBr
83,80
79,904
74,922
78,96
Мышьяк
Криптон
Бром
Селен
5
6
Xe
HI
54
Te
53
52
I
7
126,906
127,60
131,30
Теллур
Иод
Ксенон
6
8
Иондарға ыдырау күшейіп қышқылдық қасиеттері артады
Rn
At
86
85
9
(210)
(222)
Радон
Астат
10
7
RO
R 2 O 7
RO 3
R 2 O 5
RO 2
RO 4
R 2 O 3
R 2 O
ВО
RH 4
RH 3
H 2 R
HR
ЛВС
58
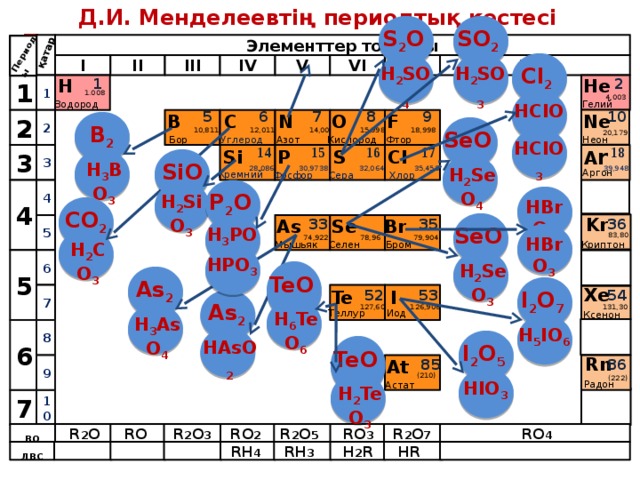
Д.И. Менделеевтің периодтық кестесі
Периодическая система химических элементов
Периоды
қатар
SO 2
S 2 O 3
Элементтер топтары
I
VIII
II
III
VII
V
IV
VI
Cl 2 O 7
H 2 SO 3
H 2 SO 4
2
Н
1
He
1
1
1.008
4,003
Гелий
Водород
HClO 4
10
6
5
9
8
7
F
O
Ne
B
C
N
2
2
B 2 O 3
10,811
15,998
12,011
14,00
18,998
SeO 3
20,179
Неон
Бор
Углерод
Азот
Кислород
Фтор
HClO 3
16
17
18
14
15
A r
Cl
S
Р
Si
3
3
H 3 BO 3
SiO 2
28,086
H 2 SeO 4
39,948
32,064
35,453
30,9738
Аргон
Кремний
Фосфор
Сера
Хлор
4
4
P 2 O 5
H 2 SiO 3
HBrO 4
CO 2
Kr
Se
Br
As
36
35
33
5
SeO 2
H 3 PO 4
83,80
HBrO 3
79,904
74,922
78,96
H 2 CO 3
Мышьяк
Селен
Криптон
Бром
5
6
HPO 3
H 2 SeO 3
TeO 3
As 2 O 5
Xe
I 2 O 7
52
53
54
Te
I
7
As 2 O 3
127,60
126,906
131,30
Иод
Теллур
H 6 TeO 6
Ксенон
H 3 AsO 4
H 5 IO 6
6
8
HAsO 2
I 2 O 5
TeO 2
Rn
86
85
At
9
(210)
(222)
HIO 3
Радон
Астат
H 2 TeO 3
10
7
R 2 O
RO
R 2 O 3
RO 2
R 2 O 5
RO 3
R 2 O 7
RO 4
ВО
RH 4
RH 3
H 2 R
HR
ЛВС
59
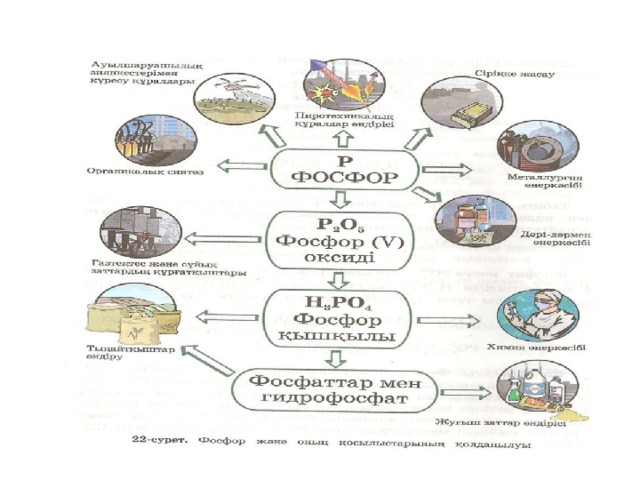
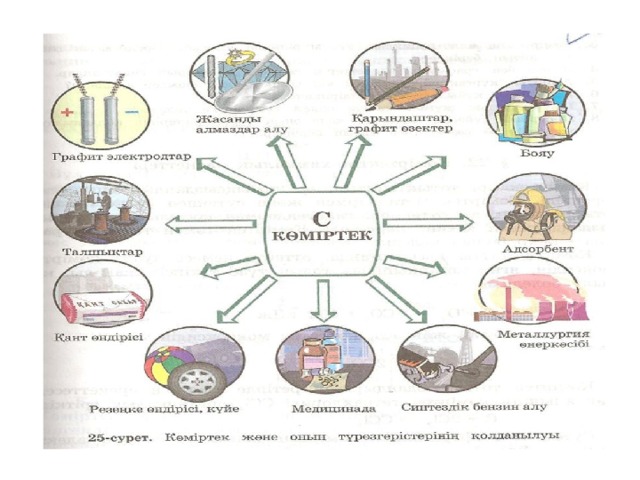
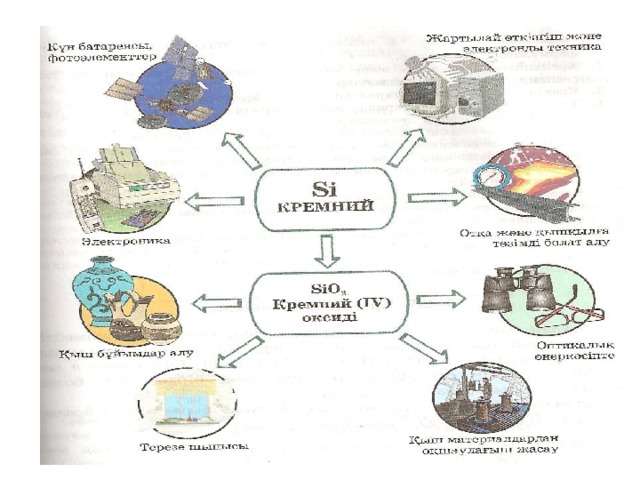
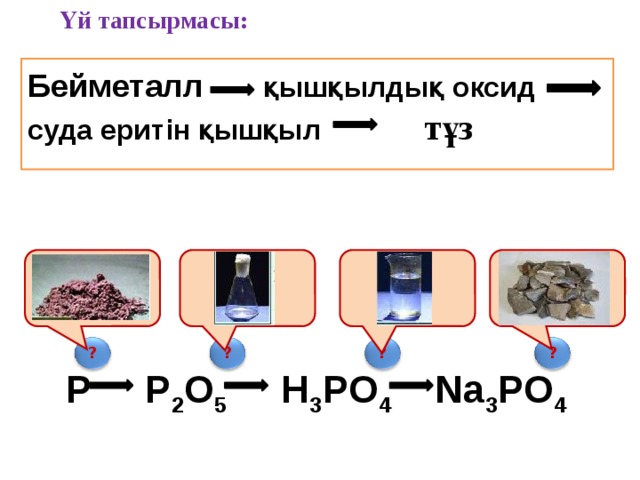
Үй тапсырмасы:
Бейметалл қышқылдық оксид
суда еритін қышқыл тұз
?
?
?
?
P P 2 O 5 H 3 PO 4 Na 3 PO 4
главная
Бейметалл қышқылдық оксид тұз → қышқыл қышқылдық →оксид → бейметалл
?
?
Si SiO 2 Na 2 SiO 3 H 2 SiO 3 SiO 2 Si
?
?
?
?
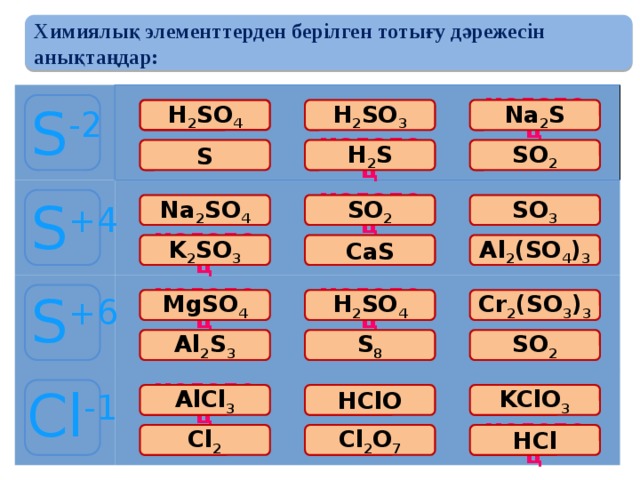
Химиялық элементтерден берілген тотығу дәрежесін анықтаңдар:
S -2
H 2 SO 4
ошибка
ошибка
молодец
Na 2 S
H 2 SO 3
ошибка
молодец
ошибка
SO 2
H 2 S
S
S +4
SO 2
SO 3
Na 2 SO 4
ошибка
молодец
ошибка
молодец
Al 2 (SO 4 ) 3
CaS
K 2 SO 3
ошибка
ошибка
S +6
молодец
ошибка
Cr 2 (SO 3 ) 3
H 2 SO 4
молодец
MgSO 4
Al 2 S 3
S 8
SO 2
ошибка
ошибка
ошибка
Cl -1
ошибка
молодец
AlCl 3
HClO
KClO 3
ошибка
ошибка
молодец
ошибка
Cl 2
Cl 2 O 7
HCl
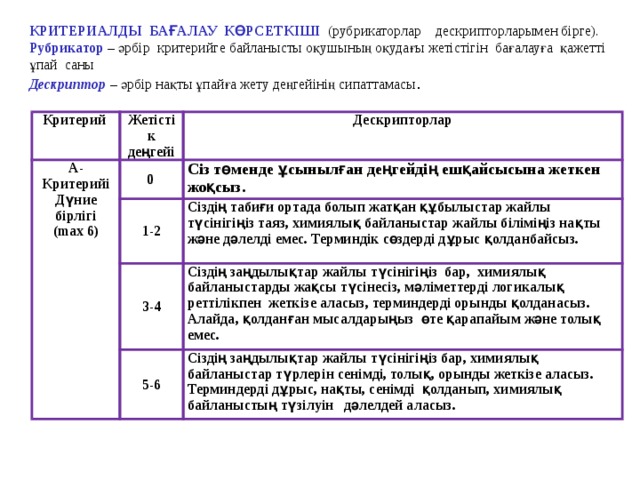
КРИТЕРИАЛДЫ БАҒАЛАУ КӨРСЕТКІШІ (рубрикаторлар дескрипторларымен бірге).
Рубрикатор – әрбір критерийге байланысты оқушының оқудағы жетістігін бағалауға қажетті
ұпай саны
Дескриптор – әрбір нақты ұпайға жету деңгейінің сипаттамасы .
Критерий
Жетістік деңгейі
А-
0
Критерийі
Дескрипторлар
1-2
Сіз төменде ұсынылған деңгейдің ешқайсысына жеткен жоқсыз.
Дүние бірлігі
(max 6)
3-4
Сіздің табиғи ортада болып жатқан құбылыстар жайлы түсінігіңіз таяз, химиялық байланыстар жайлы біліміңіз нақты және дәлелді емес. Терминдік сөздерді дұрыс қолданбайсыз.
5-6
Сіздің заңдылықтар жайлы түсінігіңіз бар, химиялық байланыстарды жақсы түсінесіз, мәліметтерді логикалық реттілікпен жеткізе аласыз, терминдерді орынды қолданасыз. Алайда, қолданған мысалдарыңыз өте қарапайым және толық емес.
Сіздің заңдылықтар жайлы түсінігіңіз бар, химиялық байланыстар түрлерін сенімді, толық, орынды жеткізе аласыз. Терминдерді дұрыс, нақты, сенімді қолданып, химиялық байланыстың түзілуін дәлелдей аласыз.

С
Ғылыми білім және түсіну
0
(max 6)
Сіз төменде ұсынылған деңгейдің ешқайсысына жеткен жоқсыз.
1-2
Сіз берілген мәтіннен қажетті ақпаратты табуда қиналасыз. Ақпараттарды талдай білмейсіз, тақырып бойынша проблеманы шешуге пайдаланған қосымша мәліметтеріңіз мақсатқа сай келе бермейді.
3-4
Сіз тақырыпқа байланысты қажетті ақпараттар мен мәліметтерді жинақтай аласыз. Дегенмен, жинақталған деректерді талдап, оны қажетті жағдайда қолдана бермейсіз.
5-6
Сіз кесте бойынша қосылыстар формулаларынан химиялық байланыстың түрлерін ажырата аласыз, сараптау жұмысын жүргізе аласыз, берілген мәтіндерден қажетті ақпараттарды тауып, ғылыми ақпараттарды тақырып бойынша туындаған проблемаларды шешуде қолдана аласыз.

E
Деректерді өңдеу
0
(max 6)
Сіз төменде ұсынылған деңгейдің ешқайсысына жеткен жоқсыз.
1-2
Сіз есептеулерді өз бетінше жүргізе алмайсыз, қателіктер жібересіз.
3-4
Сіз периодтық кестені пайдаланып элементтердің тотығу дәрежесі мен валенттілігін анықтауда қатіліктер жібересіз. Ақпараттарды қорытып, химиялық байланысты сызбанұсқалар түрінде тек мұғалімнің көмегімен көрсете аласыз.
5-6
Сіз өздігінен периодтық кестені пайдаланып элементтердің тотығу дәрежесі мен валенттілігін анықтап, формула құрастыра аласыз. Ақпараттарды қорытып, химиялық байланысты сызбанұсқалар түрінде көрсете аласыз.


Назарларыңызға рахмет!

 Получите свидетельство
Получите свидетельство Вход
Вход











 Бейметалдар күкірт, азот (5.69 MB)
Бейметалдар күкірт, азот (5.69 MB)
 0
0 2295
2295 21
21 Нравится
0
Нравится
0







