Контрольная работа № 1 «Теория ЭД».
I вариант.
1 уровень (средний).
1. Напишите молекулярные и полные и сокращенные ионные уравнения реакций между растворами:
а) нитратом серебра и хлоридом калия;
б) сульфата железа (III) и гидроксида бария;
в) соляной кислоты и нитрата серебра.
2. Напишите молекулярные и полные ионные уравнения реакций, соответствующие сокращенным:
Ca2+ + CO32-=CaCO3;
CaO + 2H+ = Ca2+ + H2O;
3. Вычислите массу осадка, который образовался при взаимодействии растворов, содержащих нитрат бария массой 26,1 и серную кислоту массой 4,5 г?
2 уровень (высокий).
Напишите уравнения реакций гидролиза следующих солей:
KI, ZnBr2.
Указать тип среды и окраску индикатора.
3 уровень (высший).
Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель:
А) H2S + HNO3 = S + NO + H2O;
Б) HCl + O2 = H2O + Cl2.
I вариант.
1 уровень (средний).
1. Напишите молекулярные и полные и сокращенные ионные уравнения реакций между растворами:
а) нитратом бария и сульфатом калия;
б) сульфатом меди (II) и сульфидом натрия;
в) гидроксидом натрия и карбонатом калия;
2. Напишите молекулярные и полные ионные уравнения реакций, соответствующие сокращенным:
Ba2+ + SO42-=BaSO4;
CuO + 2H+ = Cu2+ + H2O.
3. Какова масса осадка, который образовался при взаимодействии растворов, содержащих соответственно нитрат серебра массой 17 г и хлорид кальция массой 22,2 г?
2 уровень (высокий).
Напишите уравнения реакций гидролиза следующих солей:
KBr, K2CO3.
Указать тип среды и окраску индикатора.
3 уровень (высший).
Расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель:
А) H2SO4 + Сu = Сu SO4 + SO2 + H2O;
Б) KNO2 + KClO + KClO3 = KCl + KNO3.
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход



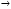 AlCl3
AlCl3








 Авторские контрольные работы по химии (4 раздела по 5 заданий) (64.42 КB)
Авторские контрольные работы по химии (4 раздела по 5 заданий) (64.42 КB)
 1
1 1359
1359 103
103 Нравится
0
Нравится
0


