Прежде, чем узнать, что такое ионная связь и как она образуется, побываем в одной удивительной стране.
Народ этой страны был беден, но беспечен. Хотя в карманах у большинства из них не было ни одной свободной монеты (а «валюта» в этой стране называлась электронами), никто не горевал по этому поводу. Напротив, если у них заводился хоть один лишний электрон, то характер их портился, они становились агрессивными и даже опасными, потому скорее хотели от него избавиться, чтобы стать опять добрыми и веселыми.
Надо сказать, что «высшая знать» этой страны отличалась от простых граждан своей скупостью. Свою «электронную валюту» они неохотно одалживали, и, наоборот, при малейшей возможности стремились забрать еще.
Давайте теперь разберёмся, кто же такие были «простые жители», а кем бала «знать».
Речь в истории шла об элементах металлах и неметаллах. Разберёмся почему.
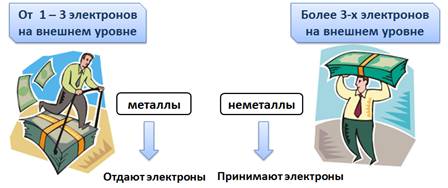
У атомов металлов на внешнем уровне всегда мало электронов (от одного до трех), естественно, что им легче отдать электроны для завершения энергетического уровня, а для неметаллов, у которых более трех электронов, легче присоединить электроны для завершения энергетического уровня.
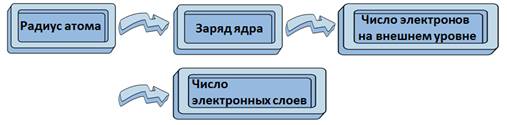
Главной характеристикой атома является заряд его ядра, от которого зависит и радиус атома. Чтобы определить число электронов на внешнем уровне достаточно знать номер группы.
Теперь, составим логическую цепочку: радиус атома зависит от заряда ядра, числа электронов на внешнем уровне, числа электронных слоев.
Рассмотрим, как изменяются металлические и неметаллические свойства по периодам и группам периодической системы.
В периодах слева направо увеличивается заряд ядра, радиус атома постепенно уменьшается, увеличивается число электронов на внешнем уровне, которые сильнее притягиваются к положительно заряженному ядру, и атомам становится легче присоединить электроны до завершения уровня, чем отдать их, поэтому металлические свойства ослабевают, а увеличиваются неметаллические.
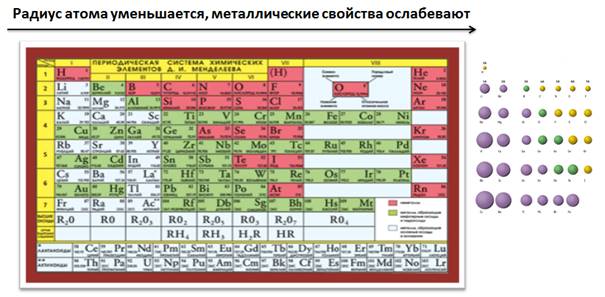
В Периодической таблице каждый период начинается металлом IA группы (это типичные металлы) и заканчивается неметаллом, в VIIA группе уже находятся типичные неметаллы.
В пределах одной группы главной подгруппы, сверху вниз увеличивается заряд ядра атома, увеличиваются радиусы атомов, число электронов на внешнем уровне остается постоянным, но увеличивается число энергетических уровней, и электроны будут удаляться от ядра, поэтому атомам их легче отдать, чем присоединить до завершения внешнего уровня, следовательно, металлические свойства будут увеличиваться, а неметаллические ослабевать. Поэтому атомы элементов, расположенные внизу в пределах одной группы, будут проявлять более металлические свойства, нежели которые находятся вверху.

Элементы VIIIА группы называют благородными или инертными газами. У всех этих атомов завершен энергетический уровень, для любого атома – это устойчивое состояние. Поэтому они не отдают и не присоединяют электроны. Они практически не соединяются с другими атомами и друг с другом, т.е. они инертны.
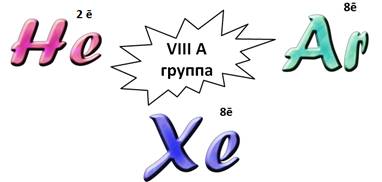
Представьте себе, встречается элемент IA группы, у которого 1 электрон, и элемент VIIA группы, у которого 7 электронов. Пусть это будут Na и Cl. У натрия один единственный электрон, а хлору как раз не хватает одного электрона для завершения внешнего уровня. Если натрий отдаст свой электрон, то он приобретет положительный заряд, а когда атом хлора заберет этот электрон, он превратится в отрицательно заряженную частицу. Эти заряженные частицы, называются ионами. Из курса физики известно, что разноименные заряды притягиваются, поэтому ион натрия и хлора соединятся и между ними возникнет химическая связь. Эта связь и будет называться ионной. В результате этого взаимодействия образуется ионное соединение. Для выражения этих ионных соединений пользуются формульными единицами, т.е. говорят не молекула NaCl, а формульная единица NaCl.
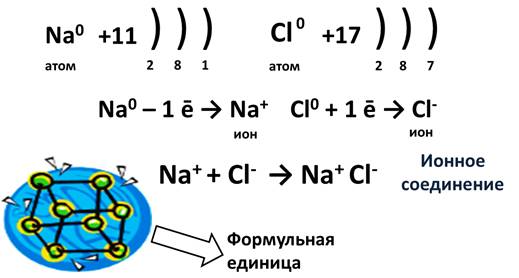
Ионная связь образуется между типичным металлом и типичным неметаллом.
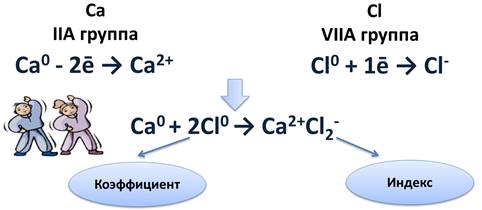
Схема образования ионной связи между атомами кальция и хлора
Кальций расположен во IIA группе, значит, на внешнем энергетическом уровне у него два электрона, которые легче отдать, чем присоединить шесть до завершения энергетического уровня. После чего он становится положительным ионом.
Са0 - 2ē → Са2+
Атому хлора, у которого на внешнем уровне 7 электронов, легче присоединить 1 электрон до завершения уровня, чем отдать 7 электронов. После присоединения 1 электрона, атом хлора становится отрицательным ионом.
Cl0 + 1ē → Cl-
Найдём наименьшее общее кратное между образовавшимися ионами. Оно равно двум. Следовательно, нужно взять 1 атом кальция и 2 атома хлора. Это схематично можно показать так:
Ca0 + 2Cl0 → Ca2+Cl2-.
Цифра 2, стоящая перед атомом хлора, называется коэффициентом. Коэффициент обычно показывает число атомов, молекул или формульных единиц, а цифра 2 после иона хлора, называется индексом. Индекс показывает число атомов в молекуле или ионов в формульной единице.
Возвращаясь истории, нетрудно догадаться теперь, почему «простыми» жителями были металлы, а «знатью» неметаллы.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 24960
24960

