Быть может, эти электроны –
Миры, где пять материков,
Искусство, знания, войны, троны
И память сорока веков.
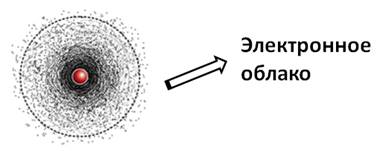
Вспомним, из чего состоит атом. Помните планетарную модель строения атома, согласно которой, в центре атома расположено положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны, подобно тому, как вращаются планеты вокруг Солнца.
Строение атома
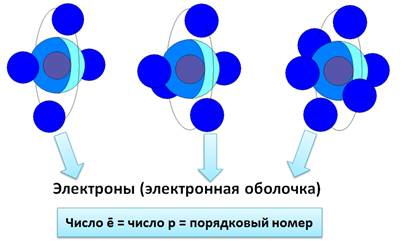
Электроны, двигаясь вокруг ядра, в совокупности образуют электронную оболочку атома. Число электронов в атоме равно числу протонов в ядре и соответствует порядковому номеру элемента.
Электроны двигаются в определённом порядке и различаются своей энергией. Электроны с маленьким запасом энергии расположены ближе к ядру, они связаны крепко с ядром и их тяжелее вырвать из электронной оболочки. А вот электроны с большим запасом энергии, напротив, находятся дальше от ядра, слабо с ним связаны, поэтому их легче оторвать.
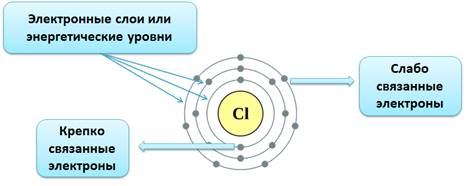
Несмотря на это, в атоме находятся электроны, которые имеют близкие значения энергии. Эти электроны образуют электронные слои, или энергетические уровни.
Чтобы определить число энергетических уровней, достаточно знать номер периода, в котором находится данный элемент. Например, у азота семь электронов в атоме, и два энергетических уровня. Теперь распределим эти семь электронов по уровням. Получается на первом их 2, а на втором – оставшиеся 5.

Максимальное число электронов на энергетическом уровне определяется по формуле: 2n2, где n – номер периода.
Если подставить значения первых трех периодов, то получится, что максимально на первом энергетическом уровне возможно только 2 электрона, на втором – 8, на третьем – 18.

Число электронов на внешнем энергетическом уровне для элементов главных подгрупп равно номеру группы.
Рассмотрим это на примере атома натрия.
Ядро атома натрия имеет заряд +11, т.е. и электронов в атоме тоже 11. Натрий находится в третьем периоде, значит, у него три энергетических уровня, которые мы будем изображать в виде скобки «)». Это записывают с помощью электронной формулы следующим образом: 11Na 2ē, 8ē, 1ē.
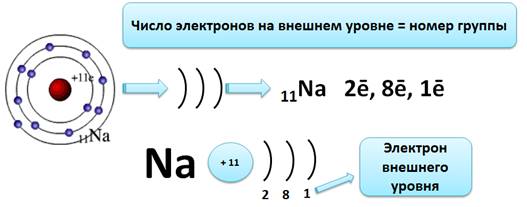
И так, на первом уровне 2 электрона (это максимально), на втором – 8 (больше быть не может), а на третий остается один электрон. Вот этот электрон и будет электроном внешнего энергетического уровня. Натрий – элемент главной подгруппы I группы, поэтому число электронов на внешнем уровне равно номеру группы, т.е. единице.
Двигаясь, электроны образуют своеобразный рисунок, так называемое электронное облако, которое можно ещё назвать орбиталью. Электронное облако, или орбиталь, – пространство вокруг ядра, где наиболее вероятно нахождение данного электрона.
На всех энергетических уровнях есть s-орбитали, они сферической формы, и она только одна, на втором уровне уже появляются p-орбитали, которые имеют форму гантели, их всего три. На каждой орбитали максимально может находится не более двух электронов, следовательно, на s-орбитали – их два, на р-орбитали – шесть.
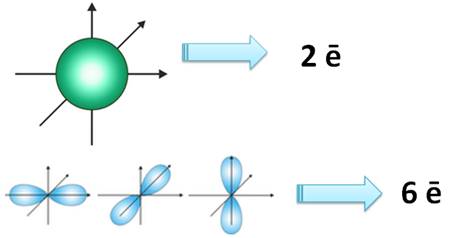
Для того, чтобы записать электронную формулу атома, для обозначения уровня используют арабские цифры, орбитали соответственно буквами s и р, а число электронов данной орбитали – арабской цифрой сверху справа над буквой орбитали.
Например, азот будет иметь электронную формулу 1s22s22p3.

Если элементы имеют одинаковое число электронов на внешнем уровне, значит, у них будут схожие свойства. Вспомните, благородные газы – инертны, не вступают в химические реакции, ведь у них, кроме гелия, восемь электронов на внешнем уровне, который считается завершенным. Вот почему они все инертны.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 34604
34604

