Амфотэрность с греческого означает и тот, и другой. Их двойственность выражается в том, что они могут проявлять и основные, и кислотные свойства.
Амфотэрными называются соединения, которые в зависимости от условий могут проявлять и кислотные, и основные свойства.
Среди неорганических веществ амфотэрными являются оксиды и гидроксиды пэ-элементов. Например: оксиды и гидроксиды цинка, алюминия, бериллия и других элементов, а также оксиды и гидроксиды некоторых дэ-элементов.

Амфотэрные соединения в реакции с кислотой ведут себя как основания, в реакции с основания выступают в роли кислот.


С точки зрения теории электролитической диссоциации кислоты – это электролиты, при диссоциации которых в качестве катионов образуются катионы водорода. Основания – это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Рассмотрим изменение кислотно-основных свойств гидроксидов.
Для примера возьмём строение гидроксида натрия, гидроксида алюминия и серной кислоты.
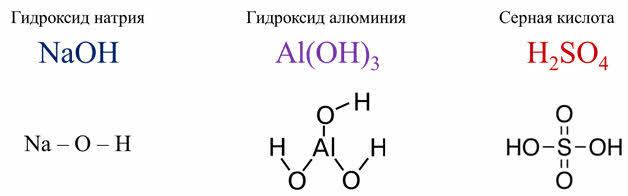
У этих гидроксидов будет по-разному разрываться связь. В гидроксиде натрия связь натрий-кислород полярнее, чем между кислородом и водородом.
Поэтому гидроксид натрия будет диссоциировать на ионы натрия и гидроксид-ионы. В серной кислоте атомы водорода и кислорода значительно отличаются по электроотрицательности, чем между серой и кислородом. Поэтому серная кислота диссоциирует с образованием катионов водорода и сульфат-ионов.
Таким образом, в периодах с увеличением порядкового номера происходит ослабление основных свойств и усиление кислотных свойств гидроксидов.

Рассмотрим свойства бескислородных соединений.
Вспомним, согласно протолитической теории, кислоты – это вещества, группы атомов или ионы, которые являются в данной реакции донорами катионов, то есть отдают катионы водорода.
Основания – это вещества, группы атомов или ионы, которые являются акцэпторами катионов, то есть принимают протоны водорода.
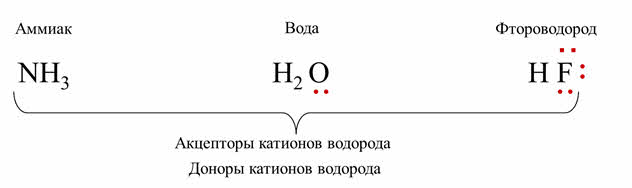
Например, рассмотрим водородные соединения неметаллов: аммиака, воды и фтороводорода.
У атома азота в аммиаке одна неподелённая пара электронов, у кислорода в молекуле воды – две неподелённые пары, а у фтора во фтороводороде – три.

В этих молекулах есть неподелённые пары электронов, что позволяет им быть акцэпторами катионов водорода и проявлять основные свойства. Но в молекулах веществ есть и неметаллы – атомы водорода. При отрыве атомов водорода, соединение может быть донором катионов водорода, то есть проявлять кислотные свойства.
Например, в реакции аммиака с водой, катион водорода отделяется от воды, потому что связь между кислородом и водородом более полярная, чем между азотом и водородом, так как разница в электроорицательности кислорода и водорода больше, чем между азотом и водородом.
Этот катион водорода присоединяется к аммиаку. То есть вода здесь проявляет кислотные свойства, а аммиак – основные.
В реакции фтороводорода с водой от фтороводорода отделяется катион водорода, а вода тем самым является акцэптором катионов водорода, потому что связь между водородом и фтором более полярная, чем между кислородом и водородом, фтороводород является кислотой, а вода – основанием.

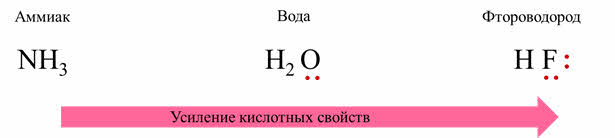
Поэтому в ряду от аммиака до фтороводорода идёт увеличение порядкового номера неметалла, основные свойства ослабевают, а идёт усиление кислотных свойств.
Таким образом, вода является амфотэрным соединением: с аммиаком вода выступает донором катионов водорода, то есть является кислотой, а в реакции с фтороводородом она будет акцэптором катионов водорода, то есть является основанием.
Амфотэрные соединения реагируют с кислотами и щелочами.
Так, в реакции с кислотами амфотэрные оксиды и гидроксиды ведут себя, как основания.
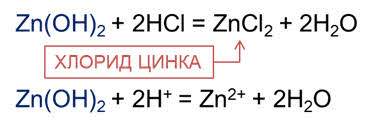
В реакции гидроксида цинка с соляной кислотой образуется соль – хлорид цинка и вода.
В реакции оксида цинка с соляной кислотой образуется соль – хлорид цинка и вода.
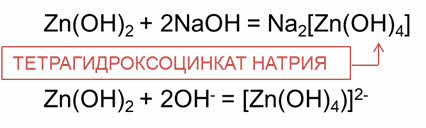
В реакциях с основаниями амфотэрные соединения ведут себя, как кислоты. Так, в реакции гидроксида цинка с гидроксидом натрия образуется тэтра-гидроксо-цинкат натрия, в реакции оксида цинка с гидроксидом натрия образуется соль – тэтра-гидроксо-цинкат натрия.

Аминокислоты являются амфотэрными органическими соединениями. В аминокислотах есть две функциональные группы: аминогруппа и карбоксильная группа.

Эти группы отличаются по свойствам. Так, аминогруппа является акцэптором катионов водорода, так как содержит азот, имеющий неподелённую пару электронов. Аминогруппа обуславливает основные свойства. Карбоксильная группа имеет сильно полярную кислород-водородную связь, поэтому является донором катионов водорода. Карбоксильная группа обуславливает кислотные свойства аминокислот.
Амфотэрные свойства аминокислот связаны с тем, что они являются бифункциональными соединениями. Аминокислота присоединяет протон водорода, который образуется при диссоциации кислоты.

При взаимодействии аминокислоты с гидроксидом натрия она проявляет кислотные свойства, так как взаимодействие происходит в карбоксильной группе.

Аминокислоты реагируют со спиртами по реакции этэрификации с образованием сложных эфиров. При чём, от кислоты отщепляется о-аш группа, а от спирта – атом водорода.

В аминокислотах возможно внутримолекулярное взаимодействие из-за наличия двух функциональных групп. Ион водорода, который образуется при диссоциации в карбоксильной группе, присоединяется к аминогруппе и образуется диполярный ион, как бы внутренняя соль, поэтому аминокислоты проявляют амфотэрные свойства.

Аминокислоты также реагируют друг с другом по реакции кондэнсации.

Благодаря этой реакции в рибосомах происходит биосинтез белка. В промышленности таким образом получают синтетические волокна, например, капрон.
Таким образом, к амфотэрным соединениям относятся соединения, которые могут реагировать и с кислотами, и с основаниями. Неорганическими амфотэрными соединениями являются оксиды и гидроксиды некоторых пэ- и дэ-элементов. Органическими амфотэрными соединениями являются аминокислоты.

 Получите свидетельство
Получите свидетельство Вход
Вход




 1
1 9168
9168


Изучите материал об амфотерных соединениях