С точки зрения теории электролитической диссоциации, основания – это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Но органические соединения также проявляют основные свойства, но не содержат гидроксид-ионов. Их основные свойства основаны на том, что они реагируют с кислотами с образованием солей.
Поэтому для более полного определения оснований используют протолитическую теорию, которую предложили в 1923 году Брэнстэд и Лоури.

Й. Н. Бренстед
(1879–1947)
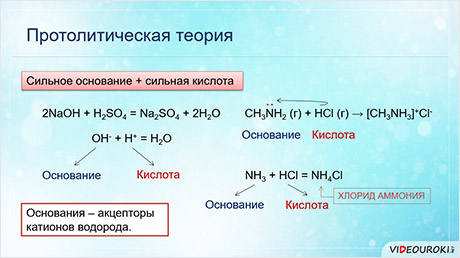
Согласно этой теории, кислоты и основания – это противоположная группа веществ, характер которой проявляется при их взаимодействии между собой. При этом кислоты – это вещества, характер которых проявляется в том, что они являются донорами катионов водорода, а основания – это вещества, которые при взаимодействии с кислотами будут принимать катионы водорода, то есть они являются акцэпторами катионов водорода.
Таким образом, согласно протолитической теории, кислоты – это вещества, группы атомов или ионы, которые являются в данной реакции донорами катионов, то есть отдают катионы водорода.
Основания – это вещества, группы атомов или ионы, которые являются акцэпторами катионов, то есть принимают протоны водорода.
Разберём эту теорию на примере взаимодействия сильного основания и сильной кислоты.

Например, при взаимодействии гидроксида натрия с серной кислотой образуется соль и вода. Сущность данной реакции связано с соединением ионов водорода и гидроксид-ионов с образованием воды.

Поэтому, согласно протолитической теории, кислотой является серная кислота, так как она является донором катионов водорода, а основанием является гидроксид натрия, так как присоединяет катионы водорода с образованием воды.
Применим протолитическую теорию к реакции взаимодействия метиламина с хлороводородом.
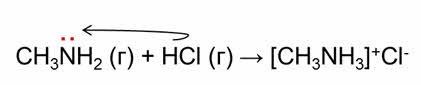
В этой реакции нет основания, так как метиламин – газ и не имеет гидроксид-ионов, и нет кислоты, потому что хлороводород тоже газ. Почему эту реакцию протолитическая теория рассматривает как взаимодействие основания и кислоты?
В молекуле амина азот имеет свободную пару электронов, он присоединяет катионы водорода по донорно-акцэпторному механизму, являясь при этом акцэптором катионов водорода, поэтому метиламин – основание. Хлороводород отдаёт катионы водорода и является кислотой.

В реакции аммиака с хлороводородом образуется соль – хлорид аммония. Аммиак выступает в роли основания, так как присоединяет катион водорода, а хлороводород выступает в роли кислоты, так как отдаёт катион водорода.
Таким образом, протолитическая теория позволяет объяснить сходство в свойствах органических и неорганических оснований, при всём различии их строения. То есть в определённых реакциях эти вещества будут проявлять себя, как акцэпторы катионов водорода.
Поэтому классификацию оснований можно дополнить. Различают основания кислородсодержащие (как гидроксид калия, гидроксид меди два), бескислородные (как аммиак, этиламин).
Основания можно классифицировать по числу катионов водорода, которые может присоединить основание. Это однокислотные основания (как гидроксид натрия, аммиак, этиламин); двухкислотные (как гидроксид кальция, этилен-ди-амин).
По растворимости в воде различают растворимые в воде основания (как гидроксид натрия, гидроксид бария, этиламин) и нерастворимые в воде (как гидроксид меди два, гидроксид железа два, анилин).
По степени диссоциации различают сильные снования, которые почти полностью диссоциируют. К ним относятся щёлочи. Слабые электролиты частично диссоциируют на ионы (к ним относятся нерастворимые основания, гидрат аммиака, гидрат метиламина).
По стабильности различают основания стабильные (как гидроксид натрия, гидроксид бария и другие) и нестабильные (как гидрат аммиака).
По летучести различают нелетучие основания – щёлочи и нерастворимые в воде основания, к летучим относятся аммиак, амины.
Гидроксиды металлов имеют ионную связь, а значит, и ионную кристаллическую решётку, поэтому это – твёрдые вещества. Бескислородные вещества имеют ковалентную связь и молекулярную кристаллическую решётку, поэтому это газы, летучие жидкости, легкоплавкие твёрдые вещества.
Химические свойства щелочей заключаются в их способности диссоциировать с образованием гидроксид-ионов, поэтому они изменяют окраску индикаторов: фенолфталеин в растворах щелочей имеет малиновую окраску, лакмус – синюю, а метилоранж – жёлтую.
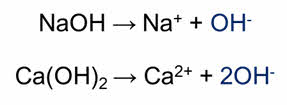
При диссоциации гидроксида натрия образуются ионы натрия и гидроксид-ионы, при диссоциации гидроксида кальция образуются ионы кальция и гидроксид-ионы.
Щёлочи реагируют с кислотами с образованием соли и воды.
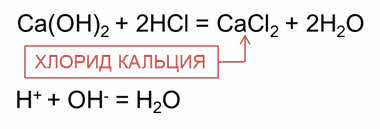
Данные реакции обмена являются реакциями нейтрализации.
Например, в реакции гидроксида кальция с соляной кислотой образуется соль – хлорид кальция и вода. В реакции многокислотных оснований может образоваться и основная соль, например гидроксохлорид кальция.

Щёлочи реагируют с кислотными оксидами с образованием солей и воды. Эти реакции являются реакциями обмена. Так, в реакции гидроксида кальция с оксидом углерода четыре образуется соль – карбонат кальция.

Щёлочи реагируют с амфотэрными соединениями. При сплавлении гидроксида натрия с оксидом цинка образуется соль – цинкат натрия, при сплавлении гидроксида натрия с гидроксидом цинка образуется соль – цинкат натрия и вода.
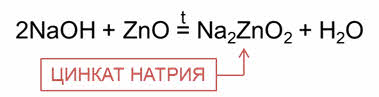
В водном растворе в реакции гидроксида натрия с оксидом цинка образуется комплексная соль – тэтра-гидроксо-цинкат натрия, в реакции гидроксида натрия с гидроксидом цинка в водном растворе также образуется комплексная соль.


Щёлочи вступают в реакции обмена с солями. В реакции гидроксида натрия с сульфатом меди два образуется соль – сульфат натрия, гидроксид меди два; в реакции гидроксида натрия с сульфатом аммиака образуется соль – сульфат натрия, аммиак и вода.

В данной реакции выделяется аммиак, который окрашивает лакмусовую бумажку в синий цвет.
Таким образом, свойства растворов щелочей обусловлены наличием гидроксид-ионов. Рассмотренные реакции идут до конца, так как в результате взаимодействия веществ образуется вода – слабый электролит, осадок или газ.
Нерастворимые основания имеют схожие химические свойства со щелочами. Они также реагируют с кислотами с образованием солей и воды.

Например, в реакции гидроксида железа два с соляной кислотой образуется соль – хлорид железа два и вода.
Нерастворимые основания при нагревании разлагаются с образованием оксида и воды. Так, в реакции разложения гидроксида меди два образуется оксид меди два (чёрного цвета) и вода.

Сила основания основана на их способности диссоциировать с образованием гидроксид-ионов. При этом разрываются связи между катионами металла и гидроксогруппой.
Так, в ряду от натрия к цэзию увеличивается радиус катиона металла, и щёлочи, образованные катионами металла лучше диссоциируют, силы притяжения с гидроксид-ионами ослабевает.

Поэтому в ряду от гидроксида натрия к гидроксиду цэзия сила оснований будет увеличиваться.

Если же металлы располагаются в одном периоде, то у них будет различаться число электронов на внешнем уровне, а также радиус катиона.

Если сравнить калий и кальций, то у кальция будет больше число электронов на внешнем уровне, но радиус атома меньше. В ряду от гидроксида натрия до гидроксида алюминия увеличивается заряд катиона металла, увеличивается сила притяжения катиона металла и гидроксогруппы, и диссоциация оснований ослабевает, значит, и сила оснований уменьшается.

Рассмотрим свойства бескислородных оснований.
Их основные свойства проявляются в том, что они являются акцэпторами катионов водорода, то есть они присоединяют катионы водорода при реакции с кислотами.
Следовательно, аммиак и амины могут реагировать с кислотами и водой, которые являются донорами катионов водорода.
Так, в реакции аммиака с соляной кислотой, аммиак присоединяет катионы водорода с образованием соли – хлорида аммония.

В реакции метиламина с соляной кислотой, метиламин присоединяет катионы водорода и образуется соль – хлорид-метил-аммония.

В реакции аммиака с водой образуется гидрат аммония, который является непрочным и диссоциирует с образованием катионов аммония и гидроксид-ионов.

Метиламин также реагирует с водой, сначала образуется непрочное соединение гидрат метиламмония, который распадается до ионов метиламмония и гидроксид-ионов.

Но анилин не даёт реакцию с водой. Почему?

Сравним по силе бескислородные основания. Сила этих оснований зависит от способности присоединять катион водорода.
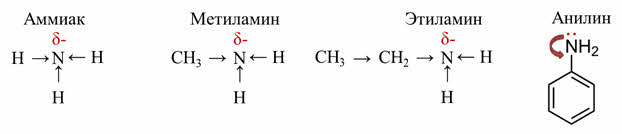
Эта способность основана на величине частичного отрицательного заряда на атоме азота. В молекуле аммиака есть частичный отрицательный заряд. В метиламине частичный отрицательный заряд у азота больше, чем в аммиаке, так как он создаётся не только атомами водорода, но и метильной группой. В этиламине частичный отрицательный заряд у азота ещё больше, чем в метиламине, потому что этильный радикал увеличивает отрицательный заряд на томе азота. В анилине ароматическое кольцо оттягивает электронную пару от азота и уменьшает величину отрицательного заряда, поэтому в ряду от анилина до этиламина будет идти усиление основных свойств.

Рассмотрим получение щелочей – растворимых в воде оснований.
Их можно получить в реакции активных металлов с водой, основных оксидов с водой. Так, в реакции натрия с водой образуется щёлочь – гидроксид натрия и водород. В реакции оксида натрия с водой образуется также гидроксид натрия.

Нерастворимые основания получают в реакции щелочей с солями.
Например, в реакции сульфата железа два с гидроксидом натрия образуется соль – сульфат натрия и нерастворимое основание – гидроксид железа два.
Амины получают восстановлением нитросоединений. При восстановлении нитрометана образуется метиламин.
Таким образом, свойства кислородсодержащих оснований основано на наличии гидроксид-ионов, свойства же бескислородных оснований заключаются в способности присоединять катионы водорода. К неорганическим основаниям относятся щёлочи и нерастворимые в воде основания, а к органическим – амины.

 Получите свидетельство
Получите свидетельство Вход
Вход




 6180
6180

