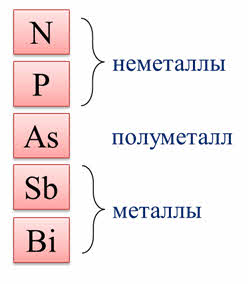
К пятой A группе периодической системы относятся азот, фосфор, мышьяк, сурьма и висмут. Азот и фосфор являются неметаллами, мышьяк относится к полуметаллам, а сурьма и висмут – к металлам.
У атомов элементов пятой A группы на внешнем энергетическом уровне находится по пять электронов, электронная конфигурация их внешнего электронного слоя эн-эс-два эн-пэ-три.
ns2np3
В химических соединениях атомы азота и фосфора могут проявлять степени окисления от минус трёх до плюс пяти.
Объёмная доля азота в воздухе составляет 78 %, он входит в состав земной коры и живых организмов. В космосе азот занимает четвёртое место по распространённости, вслед за водородом, гелием и кислородом.

Фосфор в природе встречается только в виде соединений, важнейшими из которых являются фосфориты и апатиты, содержащие фосфат кальция.
Соединения фосфора есть в организме человека, при чём часть его распределена в мышечной, нервной и мозговой тканях. В виде производного фосфорной кислоты фосфор входит в состав ДНК и РНК.
Из фосфора, который поступает с пищей в организм человека, строится АТФ. В организме взрослого человека содержится фосфор массой нуль целых семьдесят пять сотых килограмма. Особенно много фосфора содержат кости скелета и зубы.
Простое вещество азот состоит из двухатомных молекул, где атомы азота связаны между собой тройной ковалентной неполярной связью (одна сигма-связь и две пи-связи).

Энергия тройной связи велика, поэтому разрыв связей и образование атомов из молекул осуществляется только при температуре выше трёх тысяч градусов по Цэльсию. Высокая прочность связи объясняет химическую инэртность азота. При повышении давления растворимость азота в жировых и белковых тканях организма увеличивается. Это приводит к состоянию «азотного наркоза» у водолазов: человек перестаёт уверенно управлять своими движениями. Поэтому при погружении на большие глубины вместо сжатого воздуха пользуются искусственной дыхательной смесью, в которой азот заменён гелием.
Элемент фосфор образует несколько аллотропных модификаций, различающихся между собой по строению, физическим свойствам и химической активности.
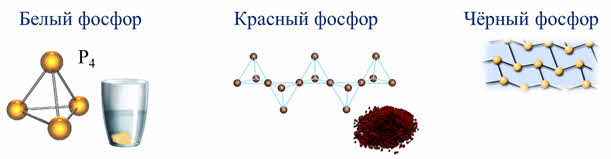
Белый фосфор имеет форму тэтраэдра, имеет молекулярное строение, поэтому он легкоплавкий и летучий. Красный фосфор имеет атомную полимерную структуру, в которой атом фосфора связан с тремя другими атомами ковалентными связями.
При нагревании под давлением белый фосфор переходит в чёрный, который имеет атомную слоистую кристаллическую структуру. Чёрный фосфор, как металлы, проводит электрический ток и блестит.
Химические свойства элементов пятой A группы на примере азота и фосфора.
При обычных условиях молекулярный азот реагирует лишь с некоторыми металлами, например, литием, при этом образуется нитрид лития.

Азот в данной реакции является окислителем. Нитриды активных металлов представляют собой ионные соединения, которые гидролизуются водой с образованием аммиака.
В реакциях фосфора с металлами образуются фосфиды, так, в реакции кальция с фосфором образуется фосфид кальция. Фосфор в данной реакции является окислителем.

Только под действием электрического разряда азот реагирует с кислородом с образованием оксида азота два. В данной реакции азот является восстановителем.

Фосфор легко окисляется кислородом, при этом образуется оксид фосфора пять или оксид фосфора три. Фосфор этих реакциях является восстановителем.


Реакция азота с водородом протекает при температуре и давлении, в присутствии катализатора – металлического железа. При этом образуется аммиак. Азот в данной реакции является окислителем.

Фосфор с водородом не реагирует.

При высоких температурах азот реагирует с другими неметаллами, например, с бором, с образованием нитрида бора. Азот в данной реакции является окислителем.

Азот непосредственно не взаимодействует с галогенами и серой, но галогениды и сульфиды могут быть получены косвенным путем.
Фосфор взаимодействует со многими простыми веществами – галогенами, серой, проявляя окислительные и восстановительные свойства.
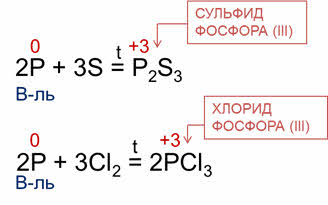
Так. В реакции фосфора с серой образуется сульфид фосфора три, фосфор в данной реакции является восстановителем.
В реакции фосфора с хлором образуется хлорид фосфора три. В этой реакции фосфор – восстановитель.
С водой, кислотами и щелочами азот не взаимодействует.
Фосфор взаимодействует с водой, при этом диспропорционирует с образованием фосфина и фосфорноватистой кислоты.

В растворах щелочей диспропорционирование происходит в большей степени.

Сильные окислители превращают фосфор в фосфорную кислоту.


Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль.


Современные спички, зажигающиеся при трении о специальную поверхность, изобретены в 1855 г. в Швеции.
На боковые поверхности спичечной коробки наносят массу, состоящую из красного фосфора, оксида железа три, соединений сурьмы и марганца, примеси измельчённого стекла и клея. При трении спичечной головки о фосфорные намазки происходит воспламенение.

Основная область применения азота – производство аммиака. Азот применяют для создания инэртной среды при сушке взрывчатых веществ, при хранении ценных произведений живописи и рукописей. Азотом ещё наполняют электрические лампы.
Красный фосфор используется для производства спичек, фосфорной кислоты, которая необходима для производств фосфорных удобрений и кормовых добавок для животных. Фосфор необходим и для производства ядохимикатов.
Соединения мышьяка чрезвычайно ядовиты, их широко используют для уничтожения грызунов и насекомых. И, тем не менее, в малых дозах соединения мышьяка входят в состав лекарств, используемых в качестве обезболивающих средств в стоматологии.

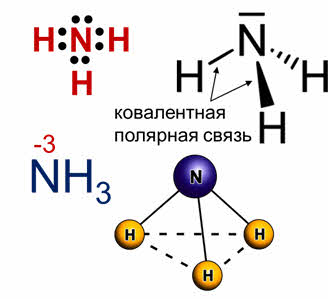
Среди соединений азота с водородом одним из важных является аммиак. Химическая связь между атомами водорода и азота является ковалентной полярной, причём общие электронные пары сильно смещены к азоту, степень окисления которого в аммиаке минус три. Молекула аммиака имеет форму пирамиды, в вершине которой расположен атом азота, а основание пирамиды составляет треугольник из атомов водорода.
Аммиак представляет собой бесцветный газ, с резким характерным запахом, хорошо растворяется в воде. Двадцати-двадцати пяти процентный раствор аммиака в воде – аммиачная вода, а пяти-десяти процентный раствор – нашатырный спирт.
Аммиак в европейских странах звучит как «аммоникон», своё название он получил благодаря оазису Аммона в Северной Африке. В жарком климате мочевина, которая содержится в испражнениях животных разлагается очень быстро и при этом образуется аммиак.

В промышленности аммиак получают синтезом азота и водорода в присутствии катализатора – губчатого железа с примесями оксида алюминия и калия), при высоком давлении и температуре.

В лаборатории аммиак получают нагреванием твёрдых хлорида аммония и гидроксида кальция.


В реакциях аммиак проявляет восстановительные свойства за счёт азота в степени окисления минус три. В кислороде аммиак горит с образованием азота, а в присутствии катализатора образуется оксид азота два и водяной пар.
Смеси аммиака с кислородом или воздухом могут взрываться при нагревании, поэтому они опасны.

Соединение азота с водородом – гидразин сгорает на воздухе с образованием газообразных продуктов, что позволяет применять его в качестве ракетного топлива.
Аммиак проявляет также восстановительные свойства в реакциях с окислителями, например в реакциях с галогенами.

Аммиак восстанавливает металлы из их оксидов.
Аммиак растворяется в воде с образованием гидрата аммиака, который частично диссоциирует, образуя катионы аммония и гидроксид-ионы.

Основные свойства аммиака проявляются и при его взаимодействии с кислотами. В реакции аммиака с серной кислотой могут образовываться как кислые, так и средние соли.

Соли аммония диссоциируют с образованием катионов аммония и анионов кислотного остатка, они взаимодействуют с кислотами, основаниями и другими солями.



Реакция солей аммония со щелочами служит качественной реакцией на ион аммония, т.к. в результате данной реакции образуется газ с характерным резким запахом – аммиак.

Соли аммония при нагревании разлагаются:
Если же соответствующая соли аммония кислота является окислителем, то реакция разложения при нагревании протекает иначе.

В водных растворах соли аммония подвергаются гидролизу по катиону и растворы этих солей имеют кислую среду.

Аммиак находит широкое применение: его используют в производстве красителей, сухих гальванических элементов, в производстве соды, мочевины, азотной кислоты, аммиачных удобрений, как жидкое удобрение, хладагент, в производстве растворителей и в медицине.

Для азота известны и оксиды: оксид азота один, оксид азота два, оксид азота три, оксид азота четыре, оксид азота пять.
Оксид азота один и оксид азота два – это несолеобразующие оксиды, остальные его оксиды – солеобразующие кислотные. Все оксиды азота, за исключением оксида азота один, ядовиты.
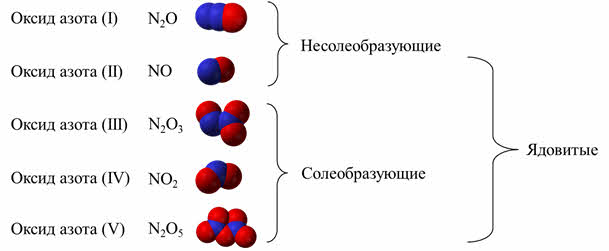
Ещё в 18 веке было замечено, что вдыхание небольших количеств оксида азота один приводит к безудержному веселью. Отсюда и название этого соединения – «веселящий газ». Длительное время его использовали для наркоза.

Для фосфора характерно два оксида: оксид фосфора три и оксид фосфора пять.

При сжигании белого или красного фосфора в кислороде образуется оксид фосфора пять в виде белого дыма.

При недостатке кислорода образуется оксид фосфора три.
Оксиды фосфора существуют в виде димеров.

Все оксиды азота проявляют окислительные свойства. Так, в реакции оксида азота пять с углеродом азот является окислителем.

Наибольшее практическое значение имеет оксид азота два и оксид азота четыре. Оксид азота четыре образуется в реакции оксида азота два с кислородом. Поэтому и говорят, что оксид азота два «буреет» на воздухе.

При растворении оксида азота четыре в охлаждённой воде одновременно образуется азотистая и азотная кислота, а в присутствии кислорода только одна азотная кислота.

Оксид фосфора пять представляет собой белый порошок, который энергично поглощает пары воды. Это его свойство – гигроскопичность используется для осушения.
Он может вызвать сильные ожоги при попадании на кожу, многие органические вещества обугливаются при действии на них этого оксида.
Оксид фосфора пять – типичный кислотный оксид, поэтом он реагирует с основными оксидами (так в реакции оксида фосфора пять с оксидом кальция образуется фосфат кальция), оксид фосфора пять реагирует и со щелочами.

В реакции оксида фосфора пять с гидроксидом натрия образуется фосфат натрия и вода.

При взаимодействии оксида фосфора пять и воды образуется ортофосфорная кислота, или просто фосфорная кислота.

У азота известно две кислоты – азотистая и азотная.

Азотистая кислота является слабой, которая существует только в растворах. При нагревании она диспропорционирует.

Так как в азотистой кислоте азот проявляет промежуточную степень окисления плюс три, то эта кислота в химических реакциях может проявлять и окислительные, и восстановительные свойства. Так, она является окислителем по отношению к сероводороду и восстановителем в реакции с перманганатом калия.

Соли азотистой кислоты – нитриты, кроме нитрита серебра один, хорошо растворимы в воде. Они используются в качестве пищевых добавок, в частности для придания приятного розового цвета мясным изделиям. Однако в больших дозах нитриты ядовиты. Нитраты щелочных, щелочноземельных металлов и аммония называются селитрами.
В молекуле азотной кислоты атом азота образует четыре ковалентные связи с атомами кислорода, поэтому валентность азота равна четырём, а степень окисления азота в азотной кислоте плюс пять.
Азотная кислота – бесцветная жидкость, с резким удушливым запахом.


Температура кипения плюс восемьдесят три градуса по Цэльсию. Плотность – полтора грамма на сантиметр кубический. Она «дымит» на воздухе и окрашивается в жёлтый цвет из-за оксида азота четыре, который образуется при разложении кислоты на свету или при нагревании.

В промышленности сырьём для получения азотной кислоты служит азот и водород.

В лаборатории азотную кислоту можно получить при действии концентрированной серной кислоты на твёрдый нитрат натрия при незначительном нагревании.


Оксиду фосфора пять соответствует фосфорная кислота. Она представляет собой твёрдое прозрачное кристаллическое вещество, хорошо растворимое в воде в любых соотношениях.
В водных растворах азотная и фосфорная кислоты диссоциируют на ионы.
Азотная кислота – сильный электролит и полностью диссоциирует на ионы.

А фосфорная кислота диссоциирует ступенчато.

Разбавленная азотная и фосфорная кислота проявляет все свойства, характерные для кислот. Они взаимодействуют с металлами, но концентрированная и разбавленная азотная кислота иначе реагирует с металлами, об этом мы говорили в предыдущих темах.
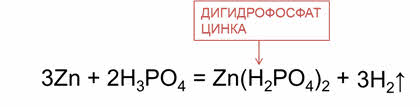
В реакции фосфорной кислоты с цинком образуется соль – дигидрофосфат цинка и водород.
Разбавленная азотная и фосфорная кислоты реагируют с основными оксидами, основаниями и солями.
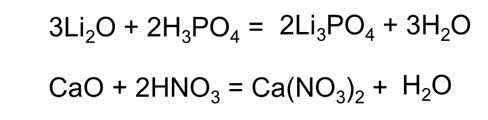
Так, в реакции оксида лития и фосфорной кислоты образуется фосфат лития и вода, в реакции оксида кальция и азотной кислоты – нитрат кальция и вода. При взаимодействии гидроксида натрия с фосфорной кислотой образуется фосфат натрия и вода, в реакции гидроксида бария с азотной кислотой – нитрат бария и вода.
При взаимодействии карбоната натрия с фосфорной кислотой образуется дигидрофосфат натрия углекислый газ и вода, в реакции силиката калия с азотной кислотой образуется нитрат калия и кремниевая кислота.

Кроме этого, азотная кислота может окислять и неметаллы, например серу и фосфор.


Качественной реакцией на фосфорную кислоту и ее соли в растворе является взаимодействие с нитратом серебра один. При этом образуется осадок фосфата серебра один желтого цвета.

Азотная кислота используется в промышленности для получения нитратов, полимерных материалов и красителей. Селитры используются в сельском хозяйстве в качестве минеральных удобрений.

Нитраты калия, аммония и натрия применяются для производства чёрного пороха и взрывчатых веществ, для производства стекла, как окислители ракетного топлива, нитраты серебра в медицинских целях.
Фосфорная кислота используется как катализатор в органическом синтезе, для производства кормовых добавок, придания кисловатого вкуса безалкогольным напиткам, в осветлении сахара, фосфаты используются для производства минеральных удобрений, для пропитки древесины, тканей и пластмасс, при производстве стиральных порошков.

Таким образом, в химических соединениях атомы азота и фосфора могут проявлять степени окисления от минус трёх до плюс пяти, простое вещество фосфор существует в нескольких аллотропных модификациях, различающихся свойствами.
Азот и фосфор проявляют как восстановительные, так и окислительные свойства.
Аммиак – водородное соединение азота, он проявляет восстановительные свойства. Аммиак реагирует с водой и кислотами. Азот образует несколько оксидов, в которых он проявляет степени окисления от плюс единицы до плюс пяти.
Азотистая кислота является слабой кислотой, которая существует только в растворе. Азотная кислота проявляет ярко выраженные окислительные свойства.
Оксид фосфора пять взаимодействует с основными оксидами и щелочами. Оксиду фосфора пять соответствует фосфорная кислота. Качественной реакцией на фосфат-ионы в растворе является реакция с нитратом серебра один.

 Получите свидетельство
Получите свидетельство Вход
Вход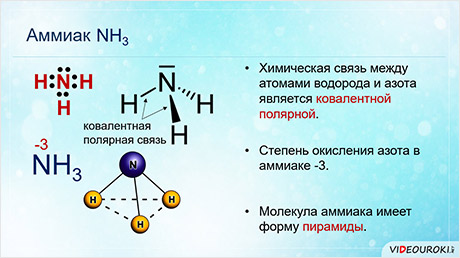




 3999
3999

