К элементам шестой A группы относятся кислород, сера, селен, тэллур, полоний. Кислород, сера, селен и тэллур имеют общее название – халькогены.
Полоний является радиоактивным элементом.

Электронная конфигурация внешнего электронного слоя атомов элементов шестой A группы эн-эс-два эн-пэ-четыре.
ns2np4
До завершения внешней электронной оболочки этим атомам не хватает по два электрона, поэтому они их отдают до завершения внешнего слоя и проявляют в своих соединениях степень окисления минус два.
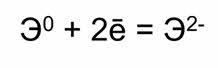
Кислород в соединении со фтором проявляет степень окисления плюс два. Атомы серы, селена и тэллура в своих соединениях с более электроотрицательными элементами проявляют положительные степени окисления: плюс два, плюс четыре и плюс шесть.
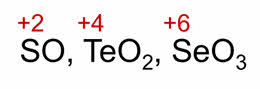
Кислород является самым распространённым элементом на Земле. В виде простого вещества этот элемент входит в состав атмосферы. В воздухе примерно содержится двадцать один процент по объёму кислорода.

Кислород входит в состав воды, в состав минералов и руд, многих органических соединений. Он просто необходим для жизни, так как участвует в процессе дыхания.
Сера в природе встречается в самородном состоянии и в виде соединений с металлами, такими как сульфиды, сульфаты. Сера относится к жизненно важным химическим элементам, она входит в состав биологических тканей всех растений и животных.

Кислород существует в виде двух аллотропных модификаций – кислорода и озона.

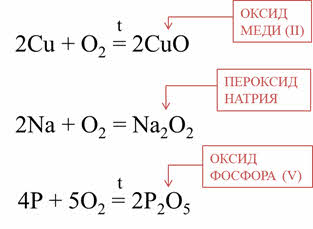
Эти вещества отличаются не только физическими свойствами, но и химическими. Кислород реагирует со всеми простыми веществами, кроме золота, платины, галогенов. Например, при взаимодействии меди с кислородом образуется оксид меди два, в реакции натрия с кислородом, образуется пероксид натрия, в реакции фосфора с кислородом образуется оксид фосфора пять.
Озон является более сильным окислителем, чем кислород. Многие малоактивные металлы, такие как серебро, ртуть, озон окисляет уже при обычных условиях.
Так, в реакции озона с ртутью образуется оксид ртути два и кислород. Повышенная окислительная способность озона объясняется тем, что от его молекулы легко отрывается один атом кислорода, который и принимает участие в окислении.

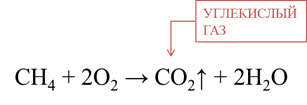
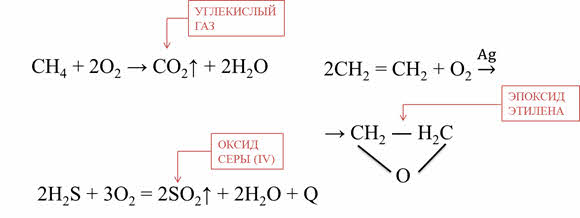
Кислород и озон способны окислять и сложные вещества. Например, при окислении метана кислородом образуется углекислый газ и вода.
В большинстве реакций с участием кислорода выделяются теплота и свет. Эти реакции называются реакциями горения. Например, сероводород горит в кислороде с образованием оксида серы четыре и воды.
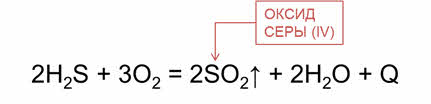
Озон воспламеняет многие органические вещества (скипидар, спирт, эфир), обесцвечивает красители. Он способен взаимодействовать с непредельными органическими соединениями с разрывом двойной связи.

Кроме этого, этот процесс способствует старению резины. Например, в реакции этилена с озоном в присутствии катализатора – серебра, образуется эпоксид этилена или окись этилена.
В лаборатории кислород можно получить различными способами. Например, при разложении перманганата калия; разложением бертолетовой соли (хлората калия) в присутствии катализатора оксида марганца четыре.
В промышленности кислород получают путём сжигания воздуха с его последующей фракционной перегонкой или электролизом воды.
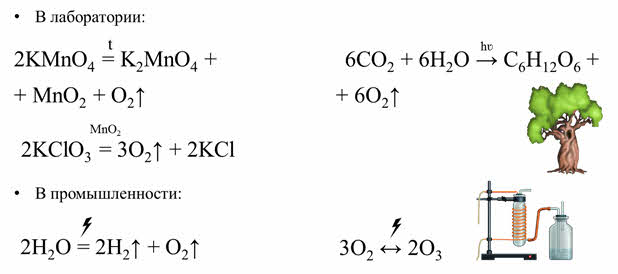
В природе кислород образуется в процессе фотосинтэза. Поглощая солнечную энергию, растения синтезируют глюкозу из углекислого газа и воды, выделяя при этом свободный кислород.
Озон получают при действии электрического разряда на кислород в устройствах – озонаторах.

В природе озон образуется при грозовых разрядах. Он существует в верхних слоях атмосферы, образуя озоновый слой, который защищает Землю и её обитателей от жёсткого ультрафиолетового излучения Солнца.
Кислород хранят в стальных баллонах, окрашенных в голубой цвет под давлением, а в лаборатории его хранят в специальных приборах – озонаторах.

Озон используется для озонирования воздуха и питьевой воды, для обезвреживания промышленных сточных вод, как дезинфицирующее средство в медицине, как окислитель ракетного топлива, в качестве отбеливающего средства.
Применение кислорода также огромно: его используют как дыхательную смесь в космосе, на подводных лодках, при тушении пожаров, в медицине кислород используют для поддержания жизни больных с затруднённым дыханием и для лечения некоторых заболеваний, в металлургической промышленности кислород используют для получения стали из чугуна, кислород используют при сварке и резке металлов, а также его используют для получения взрывчатых смесей.
Сера − является элементом шестой A группы. Представляет собой твёрдое, хрупкое вещество жёлтого цвета. В воде не растворяется.
Сера может существовать в нескольких аллотропных модификациях: это ромбическая, моноклинная и пластическая сера.
Ромбическая и моноклинная сера отличаются взаимной ориентацией циклических молекул, если расплав серы быстро охладить, то образуется пластическая сера.

Сера в химических реакциях может проявлять окислительные и восстановительные свойства.
Сера реагирует с металлами. Например, в реакции серы с натрием образуется сульфид натрия. Сера в данном случае является окислителем, так как понижает свою степень окисления с нуля до минус двух.

Сера реагирует с водородом, при этом образуется сероводород, в этой реакции сера понижает свою степень окисления с нуля до минус двух и является окислителем.
В реакции серы с углеродом образуется сероуглерод, в этой реакции сера также является окислителем, так как понижает свою степень окисления с нуля до минус двух.
Сера горит в кислороде с образованием оксида серы четыре. В этой реакции сера проявляет восстановительные свойства, так как повышает свою степень окисления с нуля до плюс четырёх.
Сера реагирует и с галогенами, так, в реакции серы в с фтором образуется фторид серы шесть. В этой реакции сера является восстановителем, так как повышает свою степень окисления с нуля до плюс шести.
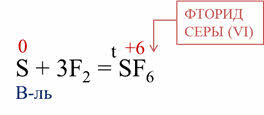
Восстановительные свойства сера проявляет и в реакции с концентрированной азотной кислотой и в реакции с концентрированной серной кислотой.
Сера вступает в реакцию диспропорционирования со щелочами. Так в реакции серы с гидроксидом натрия образуется сульфид натрия, сульфит натрия и вода.
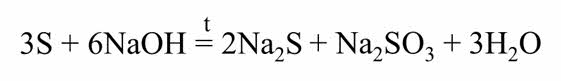
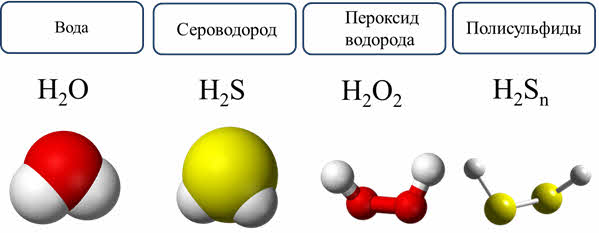
Кислород и сера образуют соединения с водородом: это вода и сероводород. Известны и другие соединения: пероксид водорода, и полисульфиды водорода.
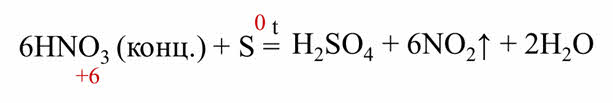
Вода – важнейший природный оксид. Вода имеет угловое строение. При обычных условиях – это жидкость, без цвета, вкуса и запаха. Вода является слабым электролитом. Пэ-аш чистой воды при обычных условиях равен семи.
Сероводород – ядовитый газ с резким неприятным запахом. В природе сероводород образуется при гниении растительных и животных организмов. Молекула сероводорода также имеет угловое строение. Сероводород термически нестоек и разлагается на простые вещества при нагревании.
Сероводород растворим в воде, при этом образуется слабая сероводородная кислота, которая диссоциирует ступенчато.
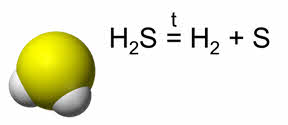
Вода в химических реакциях может быть окислителем и восстановителем. В качестве окислителя вода выступает в реакциях с активными металлами и гидридами металлов.
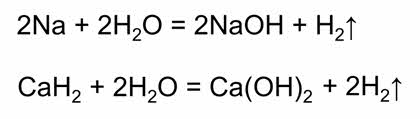
Восстановительные свойства вода проявляет в реакции со фтором.
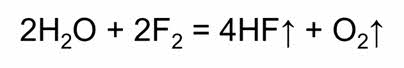
Вода способна присоединяться к молекулам или ионам. Так вода взаимодействует с оксидами металлов и неметаллов.
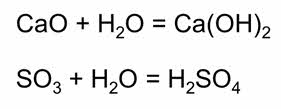
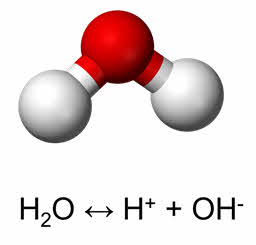
Вода способна присоединять и к органическим соединениям.
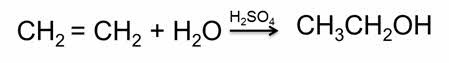
Газообразный сероводород проявляет окислительные свойства за счёт атома водорода в степени окисления плюс один. Например, в реакции с железом при нагревании образуется сульфид железа два и водород.

Наиболее характерны для сероводорода восстановительные свойства. Сероводород легко окисляется кислородом воздуха до серы и сгорает в кислороде с образованием оксида серы четыре.
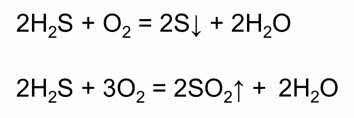
Как сильные восстановители сероводород и сероводородная кислота легко окисляются галогенами.
Сероводородная кислота также вступает в реакции обмена с основаниями и солями.
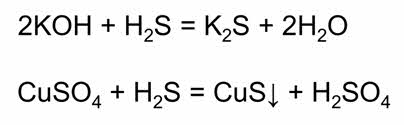
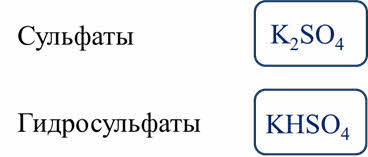
Как двухосновная кислота сероводородная кислота образует два ряда солей: сульфиды, например, сульфид калия и гидросульфиды, например, гидросульфид калия.

Большинство сульфидов, за исключением сульфидов щелочных металлов, нерастворимы. Многие сульфиды окрашены: сульфид меди два, сульфид свинца два, сульфид никеля два – чёрного цвета, сульфид кадмия – жёлтого, сульфид цинка – белого, сульфид марганца – розового.

Мягкий природный минерал чёрного цвета сурмяный блеск, или сульфид сурьмы три, женщины в старину использовали для подкрашивания бровей. В русском языке даже существовало выражение «сурьмить брови».
Пероксид водорода – ещё одно соединение кислорода. Представляет собой жидкость, которая при сорока градусах по Цэльсию разлагается с выделением атомарного кислорода.
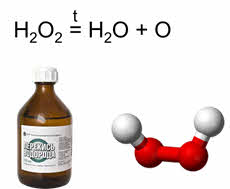
Наличие в молекуле пероксида водорода кислорода в промежуточной степени окисления минус один объясняет окислительно-восстановительную двойственность этого соединения. Так, например, в реакции с сульфитом калия пероксид водорода является окислителем.
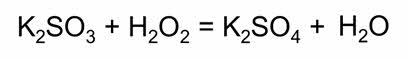
Пероксид водорода может проявлять и восстановительные свойства в реакциях с более сильными окислителями, как, например, в реакции с перманганатом калия.
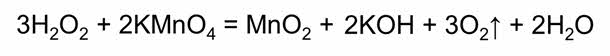
Пероксид водорода находит широкое применение для получения отбеливателей, антисептических средств, пероксидов и других соединений.
Пероксиды щелочных металлов используются для регенерации кислорода в замкнутых помещениях, например в подводных лодках.
В соединениях с кислородом сера проявляет степени окисления плюс четыре и плюс шесть. Оксид серы четыре – сернистый газ, представляет собой газ с резким, характерным запахом, который получается при горении серы.
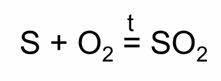
Дезинфицирующие и бактерицидные свойства оксида серы четыре широко используются для обработки овощехранилищ, фруктов, чтобы предотвратить загнивание.
Раствор оксида серы четыре в воде – это сернистая кислота, которая является двухосновной, неустойчивой кислотой.
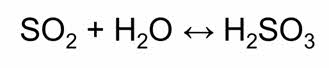
Сернистая кислота является слабой и в водных растворах диссоциирует ступенчато с образованием гидросульфит- и сульфит-ионов.
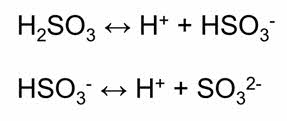
Сернистая кислота проявляет химические свойства, общие для кислот: взаимодействует с основными оксидами, основаниями, вступает в реакции обмена с солями других кислот, в частности вытесняет из солей более слабую угольную кислоту.
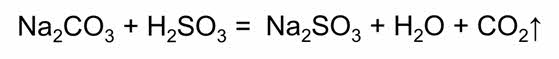
В сернистой кислоте сера находится в промежуточной степени окисления плюс четыре, поэтому сернистая кислота может проявлять окислительные и восстановительные свойства.
Восстановительные свойства она проявляет в реакциях с более сильными окислителями, например, в реакции с галогенами.
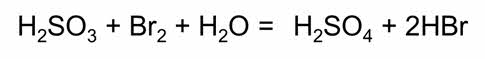
В реакции с сероводородом сернистая кислота, наоборот, проявляет окислительные свойства.
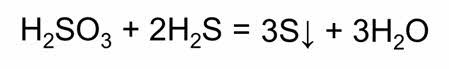
Оксид серы шесть получают окисляя оксид серы четыре в присутствии катализатора при температуре.
При обычных условиях оксид серы шесть – бесцветная едкая жидкость, которая при температуре ниже семнадцати градусов по Цэльсию превращается в белое кристаллическое вещество. Это кислотный оксид, поэтому в реакции с водой он образует сильную серную кислоту.
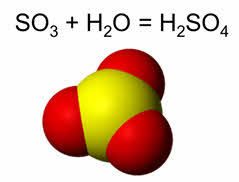
В концентрированных растворах серная кислота диссоциирует обратимо как слабый электролит, а в разбавленных она является сильным электролитом.
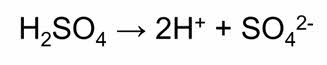
Серная кислота – тяжёлая, бесцветная маслянистая жидкость без запаха. Она смешивается с водой в любых отношениях. При приготовлении раствора серной кислоты следует кислоту вливать в воду.

Разбавленная серная кислота проявляет все свойства, характерные для кислот: взаимодействует с металлами, стоящими в ряду активности до водорода, с основными и амфотэрными оксидами, с основаниями и солями. При этом образуются средние соли – сульфаты, так и кислые – гидросульфаты.
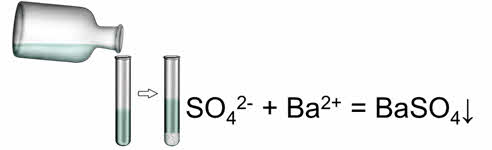
Качественной реакцией на сульфат-ион является ион бария. При этом образуется осадок белого цвета.
Таким образом, для кислорода в соединениях с другими элементами наиболее характерна степень окисления минус два, атомы серы, селена и тэллура проявляют степени окисления минус два, плюс два, плюс четыре и плюс шесть.
Для кислорода и серы характерны аллотропные модификации. Окислительные свойства кислорода и серы проявляются в их реакциях с металлами, водородом и некоторыми неметаллами.
Наиболее известными соединениями кислорода и серы являются вода, пероксид водорода, сероводород. В окислительно-восстановительных реакциях вода может быть как окислителем, так и восстановителем. Водный раствор сероводорода является слабой сероводородной кислотой. В газообразном виде и в растворах сероводород проявляет восстановительные свойства за счёт атомов серы в степени окисления минус два. Пероксид водорода обладает окислительно-восстановительной двойственностью.
Сера образует соединения с кислородом – оксид серы четыре и оксид серы шесть, эти оксиды являются кислотными. Им соответствуют кислоты: сернистая и серная. Сернистая и серная кислоты проявляют свойства, характерные для всех кислот.

 Получите свидетельство
Получите свидетельство Вход
Вход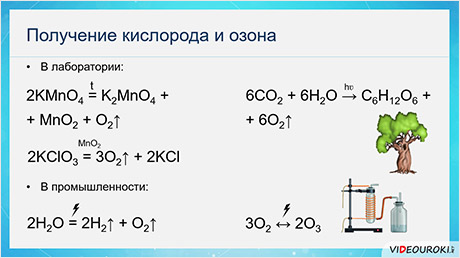




 3333
3333


