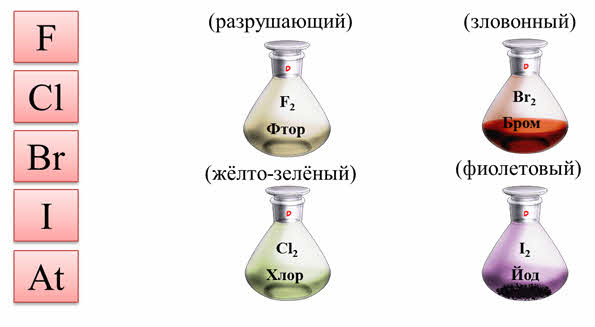
Неметаллы VIIA группы – галогены. Галогены, означает «рождающие соли». К ним относятся: фтор, хлор, бром, йод и астат, который очень редко встречается в природе. Названия галогенов образованы в соответствии с их свойствами: фтор – в переводе с греческого языка «разрушающий», хлор – «жёлто-зелёный», бром – «зловонный», йод – «фиолетовый».
Все эти элементы являются типичными неметаллами. Электронная конфигурация внешнего электронного слоя атомов галогенов ns2np5.
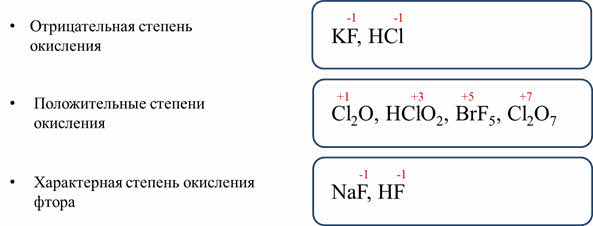
Атомы галогенов легко присоединяют недостающий до завершения электронного слоя один электрон и в своих соединениях проявляет степень окисления -1 (KF, HCl).

Хлор, бром, йод и астат в соединениях с более электроотрицательными элементами (фтором, кислородом, азотом) проявляют положительные степени окисления +1, +3, +5, +7 (Cl2O, HClO2, BrF5, Cl2O7). Для фтора характерна постоянная степень окисления -1 (HF).
Галогены в природе встречаются только в виде соединений. Так фтор, входит в состав плавикового шпата, или флюорита – CaF2, а также криолита – Na3AlF6, хлор входит в состав каменной соли, или галита – NaCl, сильвина – KCl, сильвинита – NaCl KCl, а также карналлита – KCl MgCl2 6H2O, бром содержится в морской воде, в виде бромидов – NaBr, KBr, MgBr2 в отложениях хлоридов, йод содержится в подземных буровых водах, в морских водорослях, KIO3 – в залежах селитры.

Простые вещества галогены состоят из двухатомных молекул. При обычных условиях фтор и хлор – газы, бром – жидкость, йод и астат – твёрдые вещества. Температуры кипения простых веществ галогенов сверху вниз по группе повышаются.

Все галогены – окрашенные вещества. Галогены имеют характерный резкий запах, являются весьма токсичными. Они хорошо растворяются в органических растворителях, хуже — в воде.

Получение галогенов оказалось сложным процессом. Например, фтор в свободном виде получен впервые только в 1886 году французским химиком Муассаном, который был удостоен за это Нобелевской премии. Своё название элемент получил от греческого фторос – «разрушающий».
Хлор открыт шведским химиком Шееле в 1774 году. Элемент получил название за цвет простого вещества (от греческого хлорос – жёлто-зелёный).

Карл Шееле
(1742 –1786 гг.)
Бром открыт в 1826 г. французским химиком Баларом. Элемент назван так за запах простого вещества (от греческого бромос – зловонный).
Йод получен в 1811 г. французским учёным Куртуа, а название он получил за цвет паров простого вещества (от греческого иодэс – фиолетовый).
В лаборатории хлор получают действием концентрированной соляной кислоты на перманганат калия:
16HCl + 2KMnO4 = 5Cl2↑ + 2KCl + 2MnCl2 + 8H2O
Основным методом промышленного получения хлора является электролиз водных растворов хлоридов. Так, в результате электролиза водного раствора хлорида натрия образуется гидроксид натрия, хлор и водород.
2NaCl + 2H2O = 2NaOH + Cl2↑ + H2↑
Фтор в промышленности получают электролизом расплавов фторидов. Бром и йод получают действием хлора на растворы бромидов и йодидов. Так, при действии хлора на бромид натрия образуется хлорид натрия и бром, при действии хлора на йодид натрия образуется хлорид натрия и йод.
2NaBr + Cl2 = 2NaCl + Br2
2NaI + Cl2 = 2NaCl + I2
Галогены реагируют с металлами. В этих реакциях они выступают в роли окислителей. Например, в реакции натрия с хлором образуется хлорид натрия, в реакции кальция с бромом – бромид кальция.
2Na + Cl2 = 2NaCl
Ca + Br2 = CaBr2
Галогены реагируют с растворами солей, при этом более активный галоген вытесняет из раствора соли менее активный.
Например, в реакции хлора с бромидом натрия образуется бром и хлорид натрия, в реакции йодида калия с хлором образуется бромид калия и йод.
Cl2 + 2NaBr = Br2 + 2NaCl
Br2 + 2KI = I2 + 2KBr
Галогены реагируют с водородом с образованием галогеноводородов. Фтор реагирует с водородом при обычных условиях, хлор – при действии света, реакция брома и йода с водородом идёт при нагревании. Поэтому реакционная способность галогенов по отношению к водороду понижается при переходе от фтора к йоду.
H2 + F2 = 2HF
H2 + Cl2 = 2HCl
H2 + Br2 = 2HBr
H2 + I2 = 2HI
Галогены реагируют с водой. Например, фтор разлагает воду, при этом образуется фтороводород и кислород.
2F2 + 2H2O = 4HF↑ + O2↑
В реакции хлора с холодной водой образуется соляная кислота и хлорноватистая кислота. В реакции хлора с горячей водой образуется соляная кислота и хлорноватая кислота.
Cl2 + H2O = HCl + HClO
3Cl2 + 3H2O = 5HCl + HClO3
Галогены, в частности хлор, реагируют с растворами щелочей. Так, в реакции хлора с раствором гидроксида натрия образуется хлорид натрия и гипохлорит натрия, а в реакции хлора с раствором гидроксида натрия при нагревании образуется хлорид натрия, хлорат натрия и вода.
Cl2 + 2NaOH = NaCl + NaClO + H2O
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
В качестве окислителей галогены выступают и по отношению ко многим органическим соединениям.
Например, в реакции метана с хлором образуется хлорметан и хлороводород.
CH4 + Cl2 → CH3Cl + HCl
Галогены обрзуют различные соединения с другими элементами и друг с другом. Это – галогеноводороды – соединения галогенов с водородом (HF, HCl, HBr, HI), соединения с металлами – галогениды (NaCl, CaBr2, KI), с кислородом – оксиды (Cl2O, I2O5, BrO2), гидроксиды – кислородсодержащие кислоты галогенов (HBrO, HClO2, HIO3), соединения галогенов друг с другом – интерметаллиды (ClF3, BrF5, IF7).
Галогеноводороды при обычных условиях бесцветные ядовитые газы с резким запахом.

Фтороводород представляет собой сильно дымящую на воздухе ядовитую жидкость с резким запахом. Галогеноводороды можно получить непосредственным взаимодействием водорода с галогеном.
H2 + F2 = 2HF
H2 + Cl2 = 2HCl
H2 + Br2 = 2HBr
H2 + I2 = 2HI
В лаборатории хлороводород получают действуя на на твёрдую соль концентрированной серной кислоты при нагревании:
NaCl(тв.) + H2SO4(конц.) = HCl↑ + NaHSO4

Все галогеноводороды хорошо растворимы в воде. Растворы галогеноводородов в оде являются кислотами.

Это фтороводородная кислота, или плвиковая, хлороводородная, или соляная, бромоводородная, йодоводородная.
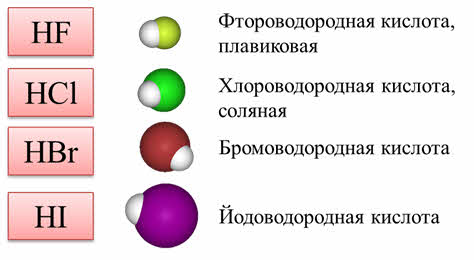
Как известно, плавиковая кислота слабая, остальные кислоты – сильные. Плавиковая кислота является слабой из-за способности её молекул к образованию ассоциатов за счёт водородных связей (H2F2).
HF↔ H+ + F-
Галогеноводороды и галогенводородные кислоты проявляют окислительные свойства за счёт атомов водорода в степени окисления +1. Так, в реакции соляной кислоты с магнием образуется хлорид магния и водород.

Магний повышает свою степень окисления и выступает в роли восстановителя. А соляная кислота является окислителем, потому что водород понижает свою степень окисления от +1 до 0.
Mg + 2HCl = MgCl2 + H2↑
Галогеноводороды и соответствующие им кислоты и их соли проявляют восстаовительные свойства за счёт атома галогена в степени окисления -1. Например, в реакции йодоводорода с азотной кислотой образуется йод, оксид азота (IV) и вода. В этой реакции йодоводород является восстановителем, так как йод повышает свою степень окисления с -1 до 0, а азотная кислота является окислителем, так как азот понижает свою степень окисления с +5 до +4.
2HI + 2HNO3 = I2 + 2NO2↑ + 2H2O
Помните, в ряду от хлороводорода до йодоводорода восстаногвительная способность усиливается. HF и фториды восстановительных свойств не проявляют.
HCl → HBr → HI
Галогенводородные кислоты образуют соли – галогениды: фториды, хлориды, бромиды, йодиды. Хлориды, бромиды и йодиды многих металлов хорошо растворимы в воде.
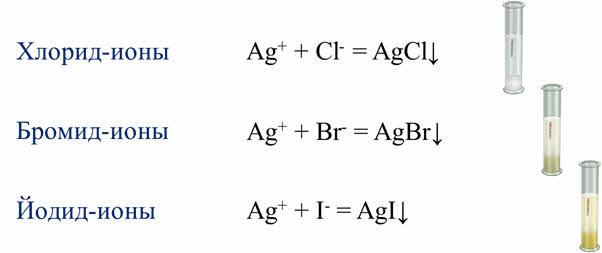
Для определения в растворе хлорид-, бромид- и йодид ионов используют реакцию с нитртом серебра (I). В результате взаимодействия хлоридов и соляной кислоты с AgNO3 выпадает белый творожистый осадок. В реакции AgNO3 с раствором бромоводородной кислоты и её солей образуется светло-жёлтый осадок, в реакции йодоводородной кислоты и её солей – жёлтый осадок. Таким образом, нитрат серебра (I) является реактивом на хлорид-, бромид- и йодид-ионы.
Для распознавания фтороводордной кислоты и фторидов нитрат серебра (I) не подходит, так как AgF растворим в воде. Поэтому для распознавания фторид-ионов используют реакцию с ионами кальция. При этом образуется белый осадок – фторид кальция.
2NaF + Ca(NO3)2 = CaF2↓ + 2NaNO3
Известен целый ряд кислородсодержащих кислот хлора и их солей. Например, HClO – хлорноватистая кислота, её соли гипохлориты, HClO2 – хлористая кислота, её соли – хлориты, HClO3 – хлорноватая, её соли – хлораты, HClO4 – хлорная кислота, её соли – перхлораты.
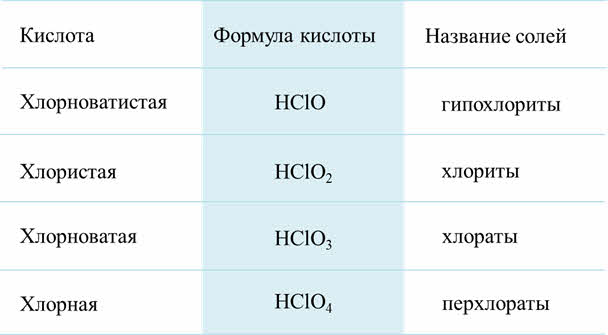
Все эти кислоты хорошо растворимы в воде. Хлорная кислота известна в свободном виде, остальные существуют лишь в разбавленных водных растворах. Например, хлорноватистая кислота получается при растворении хлора в воде. В одной объёме воды при комнатной температуре растворяется 2,3 объёма хлора. В получившейся приэтом хлорной воде устанавливается равновесие.
Cl2 + H2O ↔ HCl + HClO
Хлорноватистая кислота неустойчива: при освещении она быстро разлагается с выделением атомарного кислорода:
HClO = HCl + O
Протеканием этой реакции объясняются сильные окислительные свойства хлорной воды. Например, вней обесцвечиваются многие органические красители. Имеено из-за этой способности хлорноватистой кислоты окислять многие органические вещества в ряде стран питьевая вода обеззараживается хлором.
Гипохлориты входят в состав некоторых средств для дезинфекции и отбеливания.

Сильным дезинфицирующим средством является хлорная, или белильная известь, которая получается при взаимодействии хлора с гашёной известью:
Cl2 + Ca(OH)2 = Ca(OCl)Cl + H2O
Хлорная известь является смешаной солью соляной и хлорноватистой кислот, поэтому её называют гипохлорит-хлорид кальция.
Таким образом, хлор применяется для обеззараживания воды, отбеливания тканей и бумаги, для получения соляной кислоты, органических растворителей, ядохимикатов, в цветной металлургии для извлечения некоторых металлов методом хлорирования руд.

Фтор применяют как окислитель ракетного топлива, для получения фторорганических соединений, например, тефлона, соединение фтора NaAlF6 используется для получения алюминия.

Бром и йод используются в фармацевтической и химической промышленности, а также в производстве светочувствительных фотоматериалов.
Известно также и негативное использование галогенов и их соединений.
В начале 60-х годов появились сообщения об идее американца Генри Словитера, предлагавшего создать насыщенные кислородом воздуха эмульсии перфторуглеродов в качестве дыхательной среды и возможных кровезаменителей. Именно введение перфторана спасло многих солдат в госпиталях Афганистана. Он был не только кровезаменителем, но и оказался неожиданно эффективным средством против "жировой эмболии" – внезапной закупорки крупных кровеносных сосудов капельками жира, попадающими туда из костного мозга. Жировая эмболия – наиболее частая причина смерти при ранениях на войне.
Соединения хлора, в частности хлорид натрия, используется в спелеотерапия – использование, с целью лечения, микроклимата подземных соляных пещер.
Таким образом, галогены – сильные окислители, встречаются в природе только в виде соединений, в соединениях с другими элементами галогены (кроме фтора) проявляют степени окисления -1, +1, +3, +5, +7. Для фтора характерна постоянная степень окисления -1.
Окислительные свойства простых веществ галогенов проявляются при их взаимодействии с металлами, неметаллами и углеводородами.
Галогеноводороды можно получить при непосредственном взаимодействии водорода с галогенами. Растворы галогеноводородов в воде являются кислотами. Галогеноводородные кислоты образуют соли – галогениды. Реактивом на хлорид-, бромид-, йодид-ионы явдяется нитрат серебра (I).

 Получите свидетельство
Получите свидетельство Вход
Вход




 3495
3495

