К четвёртой A группе периодической системы относятся углерод, кремний, германий, олово и свинец. Углерод и кремний – элементы неметаллы, германий и олово – полуметаллы, а у свинца преобладают металлические свойства.

Электронно-графическая конфигурация внешнего электронного слоя атомов элементов четвёртой A группы эн-эс-два эн-пэ-два. В соединениях атомы углерода и кремния могут проявлять степени окисления минус четыре, плюс два, плюс четыре; для элементов-полуметаллов и металлов в их соединениях с другими элементами более характерны степени окисления плюс два и плюс четыре.
ns2np2
Углерод встречается в свободном состоянии и в виде соединений. Углерод является основой органической жизни на Земле.

Он содержится в угле, торфе, нефти и природном газе.

При нагревании углеродсодержащих соединений без доступа воздуха образуется аморфный углерод: кокс, древесный уголь, сажа.

В виде углекислого газа углерод входит в состав атмосферы. Наиболее известным минералом углерода является кальцит. Из кальцита состоят кораллы, раковины большинства моллюсков. Кальцит образует драгоценный камень – жемчуг, который часто называют «живым бриллиантом».
Кремний – второй по распространённости на Земле элемент после кислорода. Он широко распространён в виде кремнезёма и различных силикатов. Кремний входит в состав хвощей, бамбука, крапивы, в состав скелета, соединительной ткани. Кремний является составной частью одной из разновидностей метеоритов, называемых аэролитами.

Углерод образует несколько аллотропных модификаций: графит, алмаз, карбин и фуллерен.
В алмазе каждый атом углерода окружён такими же атомами, расположенными в вершинах правильного тэтраэдра. Это строение обуславливает твёрдость алмаза. Алмаз служит эталоном твёрдости, которая оценивается по десятибалльной шкале и оценивается высшим баллом 10. Алмаз плохо проводит теплоту и почти не проводит электрический ток.
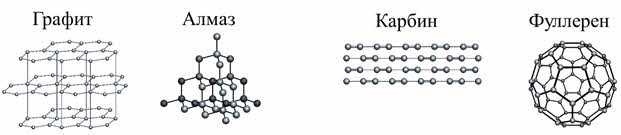
В графите атомы углерода расположены слоями, состоящими из шестичленных колец. Слоистая структура алмаза обуславливает его мягкость.
Карбин – это разновидность углерода, состоящая из углеродных цепочек, он обладает полупроводниковыми свойствами.
Фуллерены представляют собой шарообразные молекулы, образованные пяти- и шестиугольниками из атомов углерода, соединённые между собой, а внутри полые.
Существует и аморфный углерод – стеклоуглерод, где беспорядочно связаны между собой фрагменты алмаза, графита и карбина.
Кристаллическое строение кремния аналогично строению алмаза. Кристаллический кремний имеет серо-стальной цвет и металлический блеск. Он обладает полупроводниковыми свойствами.

Для углерода и кремния характерна невысокая химическая активность, поэтому большинство реакций идут только при высокой температуре.
Углерод обладает низкой реакционной способностью, из галогенов реагирует только с фтором при этом образуется фторид углерода четыре. Углерод здесь проявляет восстановительные свойства.

При обычных условиях кремний довольно инэртен, что объясняется прочностью его кристаллической решетки, непосредственно взаимодействует только с фтором, при этом образуется фторид кремния четыре. В этой реакции кремний проявляет восстановительные свойства:

При нагревании углерод взаимодействует с кислородом с образованием оксида углерода четыре или оксида углерода два. В данных реакциях углерод является восстановителем.

Измельчённый кремний при нагревании реагирует с кислородом с образованием оксида кремния четыре. Кремний в этой реакции является восстановителем.

Углерод реагирует с некоторыми другими неметаллами. Так, в реакции углерода с серой образуется сероуглерод. В этой реакции углерод является восстановителем.

Углерод не взаимодействует с азотом и фосфором.
Углерод реагирует с водородом в присутствии никелевого катализатора, образуя метан. В этой реакции углерод – окислитель.

При очень высокой температуре кремний реагирует с углеродом с образованием карбида кремния четыре – карборунда. В данной реакции кремний – восстановитель.

При высокой температуре кремний реагирует с азотом с образованием нитрида кремния четыре. В этой реакции кремний – восстановитель.

С водородом кремний не взаимодействует.
Углерод способен взаимодействовать с металлами, образуя карбиды.
Так, в реакции кальция с углеродом образуется карбид кальция. В этой реакции углерод – окислитель.
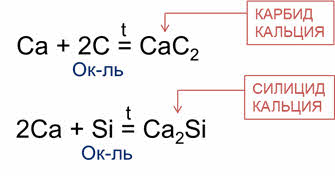
Окислительные свойства для кремния менее характерны, но они проявляются в реакциях с металлами, при этом образует силициды. В реакции кальция с кремнием образуется силицид кремния.
При пропускании водяных паров через раскаленный уголь образуется оксид углерода два и водород:

Углерод способен восстанавливать многие металлы из их оксидов. Так, в реакции оксида цинка с углеродом образуется цинк и углекислый газ. В данной реакции углерод – восстановитель.

Концентрированные серная и азотная кислоты при нагревании окисляют углерод до оксида углерода четыре.


Кремний устойчив к действию кислот, в кислой среде он покрывается нерастворимой плёнкой оксида и пассивируется.

Кремний взаимодействует только со смесью плавиковой и азотной кислот.
Кремний с фтороводородом реагирует при обычных условиях, выступая в роли восстановителя.

Кремний растворяется в щелочах, образуя силикат и водород. Например, в реакции кремния с раствором гидроксида натрия образуется силикат натрия и водород.

Кремний применяется в полупроводниковой технике и микроэлектронике, в металлургии в качестве добавки к сталям и в производстве сплавов.

Графит используют в карандашной промышленности, но в смеси с глиной – «грифельная масса». Способность графита проводить электрический ток также позволяет изготавливать из него высококачественные электроды. Его используют как смазочный материал или замедлитель в ядерных реакторах.

Сажу используют для получения чернил, при наполнении резины и при получении сапожной ваксы.

Кокс используется для получения металлов из руд.

Древесный и животный уголь применяют в пищевой промышленности для обесцвечивания сахарного сиропа, как активированный уголь.
Алмаз благодаря исключительной твердости — незаменимый абразивный материал. Алмазное напыление имеют шлифовальные насадки бормашин.

Кроме этого, огранённые алмазы — бриллианты — используются в качестве драгоценных камней в ювелирных украшениях.
Углерод образует с кислородом оксид углерода два, или угарный газ и оксид углерода четыре, или углекислый газ. Для химического элемента кремния более характерен оксид кремния четыре.
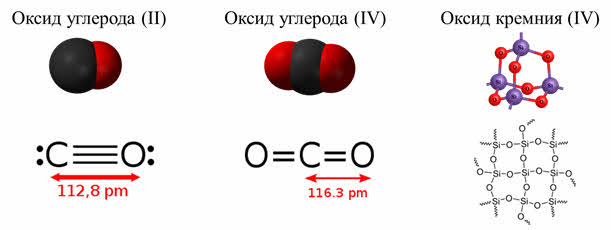
Атомы углерода и кислорода в молекуле оксида углерода два связаны между собой тройной ковалентной связью, при этом две связи образованы путём обобществления электронов, а третья по донорно-акцэпторному механизму. В молекуле оксида углерода четыре атом углерода связан с каждым из атомов кислорода двойной ковалентной связью, эта молекула имеет линейное строение.
Оксид кремния четыре является веществом немолекулярного строения, в структуре которого вокруг каждого атома кремния размещается четыре атома кислорода, каждый из которых соединяется с двумя атомами кремния.
Оксид углерода два является несолеобразующим оксидом, поэтому он не реагирует при обычных условиях ни с кислотами, ни со щелочами.
Но в реакциях с некоторыми простыми и сложными веществами этот оксид проявляет восстановительные свойства.
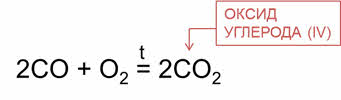
Он окисляется кислородом воздуха, превращаясь в оксид углерода четыре.
В качестве восстановителя оксид углерода два взаимодействует с оксидами металлов (эта реакция используется для получения металлов из руд).

Оксид углерода два реагирует с хлором на свету или в присутствии активированного угля с образованием фосгена.
Оксид углерода четыре и оксид кремния четыре являются кислотными оксидами, поэтому они реагируют с основаниями и основными оксидами.
С сильными восстановителями при высоких температурах оксид углерода четыре проявляет окислительные свойства. Например, он углём восстанавливается до угарного газа.

Магний, зажжённый на воздухе, продолжает гореть и в атмосфере углекислого газа.

При температуре выше тысячи градусов по Цэльсию оксид кремния четыре реагирует с активными металлами, при этом образуется кремний или при избытке восстановителя – силициды.


Оксид углерода четыре – типичный кислотный оксид. Реагирует с основными оксидами и основаниями, образуя соли угольной кислоты.
Так, в реакции оксида углерода четыре с оксидом натрия образуется карбонат натрия, в реакции оксида углерода четыре с гидроксидом натрия образуется карбонат натрия и вода, или просто гидрокарбонат.



Диоксид кремния – типичный кислотный оксид, но он не растворяется в воде, при сплавлении реагирует со щелочами.
Например, в реакции оксида кремния четыре с гидроксидом калия образуется силикат калия и вода. Он реагирует и с основными оксидами, так, в реакции оксида кремния четыре с оксидом магния образуется силикат магния.


Оксид кремния четыре реагирует с такими неметаллами, как водород, при этом образуется кремний и вода, в реакции оксида кремния четыре с углеродом образуется карборунд и оксид углерода два.


Оксид кремния четыре реагирует и с карбонатами. Так, в реакции оксида кремния четыре с карбонатом калия образуется силикат калия и углекислый газ.

Диоксид кремния с кислотами не реагирует, исключение составляет плавиковая кислота.

Оксид углерода четыре взаимодействует с водой с образованием непрочной угольной кислоты, а оксид кремния четыре с водой не реагирует.

Качественной реакцией для обнаружения углекислого газа является помутнение известковой воды.

В начале реакции образуется белый осадок, который исчезает при длительном пропускании углекислого газа через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат.

Как вы уже знаете, углекислый газ образуется при дыхании живых организмов и гниении их остатков. Он получается при сжигании угля и различных органических веществ, например, метана.

В промышленных масштабах углекислый газ получают при прокаливании известняка при высокой температуре.

В лаборатории чаще всего используют реакцию карбоната кальция с соляной кислотой.

Оксид углерода два используется как восстановитель в металлургии, как топливо, сырьё для получения органических веществ.

Углекислый газ используют для хранения продуктов питания, для газирования вод, а «сухой лёд» ─ для хранения продуктов питания, оксид углерода четыре применяют в производстве соды, сахара, используют в газовых лазерах.

Оксид кремния четыре применяется в строительстве, для получения стекла, керамики, фарфора, кирпича и цемента. Используется кварц в радиотехнике, акустоэлектронике, оптическом приборостроении, кварцевая посуда – в химических лабораториях, белая сажа используется в производстве резины.

При растворении углекислого газа в воде образуется слабая угольная кислота. Она существует только в водных растворах, где она диссоциирует ступенчато.

Для распознавания карбонатов и гидрокарбонатов используют сильные кислоты, так как в результате идёт быстрое выделение углекислого газа.


Соли угольной кислоты в водных растворах подвергаются гидролизу по аниону, поэтому растворы карбонатов и гидрокарбонатов имеют щелочную реакцию.

Карбонаты и гидрокарбонаты могут переходить друг в друга. Например, при избытке углекислого газа в присутствии воды карбонаты превращаются в гидрокарбонаты.

При нагревании все гидрокарбонаты и карбонаты, кроме некоторых щелочных металлов, разлагаются с выделением углекислого газа.

Оксиду кремния четыре соответствует кремниевая кислота, это слабая кислота, слабее даже угольной. Кремниевая кислота получается при действии более сильных кислот на силикаты.


В воде кремниевая кислота не растворяется и выпадает в виде студенистого осадка. Кремниевая кислота при нагревании или длительном хранении постепенно разлагается на воду и оксид кремния четыре.

Соли кремниевой кислоты – силикаты. Их можно получить в результате взаимодействия при высокой температуре оксида кремния четыре с оксидами металлов, карбонатами или щелочами. Большинство силикатов плохо растворимы в воде.

Среди солей угольной кислоты наибольшее практическое значении имеет карбонат кальция, который встречается в природе в виде мрамора, известняка и мела.
Мрамор и известняк используется в строительстве как облицовочный и архитектурно-строительный материал. Известняк используется для получения извести, его вносят в почву для понижения кислотности, мел – для побелки, а также в стекольной, резиновой и других отраслях промышленности.
Карбонат натрия (кальцинированная сода) и его гидрокарбонат – кристаллическая сода – используются в производстве мыла, стекла, моющих средств, красителей, в целлюлозно-бумажной промышленности, текстильной и нефтехимической.

Гидрокарбонат натрия – питьевая сода широко используется в быту, медицине, пищевой промышленности, входит в состав наполнителя для огнетушителя.

Карбонат калия – поташ – применяют в производстве стекла, мыла, в фотографии, в качестве удобрений.
Соли кремниевой кислоты – растворимые в воде силикаты натрия и калия, или «растворимые стёкла» применяются как огнеупорное средство для пропитки древесины и тканей. Для изготовления несгораемых и электроизоляционных текстильных материалов, широко используются природные силикаты – асбесты.
Природные соединения кремния: кремнезём, силикаты и глина используются для получения керамики, стекла и цемента.

Способ производства фарфора – просвечивающегося в тонком слое керамического материала – был разработан в Китае в IV – VI вв. и держался в строжайшей тайне. Однако в XIII в. Венецианский путешественник Марко Поло увёз в Италию не только образцы изделий из фарфора, но и рецепт его производства.
Таким образом, в химических соединениях с другими элементами атомы углерода и кремния могут проявлять степени окисления минус четыре, плюс два и плюс четыре. Для углерода и кремния наиболее характерны реакции, в которых они проявляют себя как восстановители. В качестве окислителей углерод и кремний выступают при взаимодействии с металлами.
Углерод образует с кислородом оксид углерода два, или угарный газ и оксид углерода четыре, или углекислый газ. Для кремния более характерен оксид кремния четыре.
Оксид углерода два является несолеобразующим оксидом. Для него характерны восстановительные свойства. Оксид углерода четыре и оксид кремния четыре являются кислотными оксидами. Они взаимодействуют с основаниями и основными оксидами.
Слабая угольная кислота существует только в растворах. Соли угольной кислоты, кроме карбонатов некоторых щелочных металлов, при нагревании разлагаются с выделением углекислого газа. Кремниевая кислота – непрочное соединение, она постепенно разлагается на оксид и воду.

 Получите свидетельство
Получите свидетельство Вход
Вход




 3310
3310

