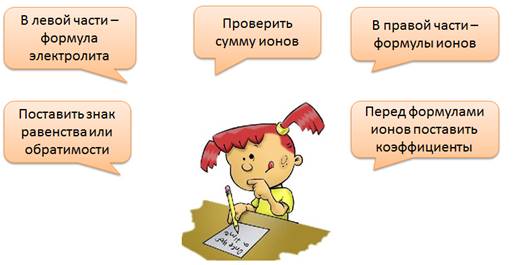
При составлении уравнений электролитической диссоциации следует поступать следующим образом: в левой части уравнения записать формулу электролита, затем поставить знак равенства или обратимости в зависимости от силы электролита. В правой части записать формулы образующихся положительно и отрицательно заряженных ионов, указав значения и знаки их зарядов. Перед формулами ионов поставить коэффициенты, затем проверить сумму положительных и отрицательных ионов, она должна быть равна нулю.
Кислоты – это электролиты, при диссоциации которых образуются катионы водорода и анионы кислотного остатка.
Сильные кислоты диссоциируют полностью по одной ступени:
HCl = H+ + Cl-
HNO3 = H+ + NO3-
H2SO4 = 2H+ + SO42-
При диссоциации сильных кислот ставится знак равенства, а при диссоциации слабых кислот вместо знака равенства ставится знак обратимости.
HNO2 ⇆ H+ + NO2-
Многоосновные слабые кислоты диссоциируют ступенчато. На каждой стадии отщепляется ион водорода. Например, диссоциация фосфорной кислоты идет в 3 ступени:
1) H3PO4 ⇆ H+ + H2PO4-
2) H2PO4- ⇆ H+ + HPO42-
3) HPO42- ⇆ H+ + PO43-
Следует учитывать, что диссоциация, в данном случае, по второй ступени протекает намного слабее, чем по первой, а диссоциация по третьей ступени при обычных условиях почти не происходит.
Как видно, все кислоты при диссоциации образуют катионы водорода, поэтому они имеют кислый вкус и изменяют окраску индикаторов: лакмус и метилоранж становятся красными.
Основания – это электролиты, при диссоциации которых образуются катионы металла и в качестве анионов гидроксид-ионы.
Сильные электролиты – щёлочи – диссоциируют полностью по первой ступени.
NaOH = Na+ + OH-
Ca(OH)2 = Ca2+ + 2OH-
Многоосновные слабые основания диссоциируют ступенчато и вместо знака равенства ставится знак обратимости. Например, гидроксид меди (II) диссоциирует по двум ступеням:
1) Cu(OH)2 ⇆ CuOH+ + OH-
2) CuOH+ ⇆ Cu2+ + OH-
Т.к. при диссоциации оснований образуются гидроксид-ионы, то они будут иметь схожие свойства, такие как мыльность на ощупь, изменение окраски индикаторов: лакмус становится синим, метилоранж – жёлтым, фенолфталеин – малиновым.
Соли – это электролиты, при диссоциации которых образуются катионы металлов (или аммония) и анионы кислотного остатка.
Соли диссоциируют по одной ступени, в отличие от кислот и оснований.
NaCl = Na+ + Cl-
NH4NO3 = NH4+ + NO3-
Al2(SO4)3 = 2Al3+ + 3SO42-
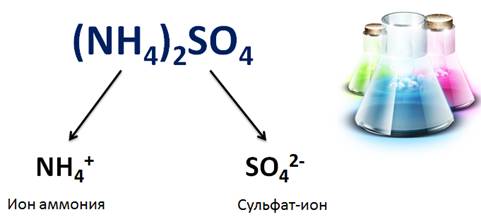
Свойства солей определяются как катионами металла, так и анионами кислотного остатка. Например, соли аммония имеют общие свойства, обусловленные наличием иона аммония (NH4+), так и различные, обусловленные анионами кислотного остатка. Общие свойства сульфатов – солей серной кислоты – обусловлены наличием сульфат-ионов, а специфические свойства обусловлены различными катионами.
Кислые соли, в отличие от средних, диссоциируют ступенчато: первая ступень сопровождается диссоциацией катиона металла и аниона кислотного остатка, содержащего ион водорода, вторая ступень – это отщепление иона водорода и кислотного остатка.
NaHCO3 = Na+ + HCO3-
HCO3- ⇆ H+ + CO32-

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 33562
33562

