Одни вещества способны проводить электрический ток, другие нет. Существует специальный прибор для определения электропроводности. Он состоит из стакана, в который наливают исследуемый раствор. В стакан вставляются угольные электроды. От клем электродов идут провода: один провод соединён с лампочкой, другой – с источником тока. Если раствор проводит электрический ток, то лампочка загорается, если нет, то лампочка не загорается. Чем ярче загорается лампочка, тем лучше раствор проводит электрический ток, и наоборот.

Проведём эксперимент: опустим электроды в стакан с твердым хлоридом натрия и в стакан с сахаром. Лампочка не загорается. Значит, эти вещества не проводят электрический ток. Опустим электроды в стакан с дистиллированной водой, лампочка тоже не загорается. Но если опустить электроды в стакан с водными растворами хлорида натрия, сахара и в стакан с соляной кислотой, то лампочка загорается только тогда, когда электроды были в стакане с раствором соляной кислоты и раствором хлорида натрия, а водный раствор сахара не проводит электрический ток.

Вещества, водные растворы и расплавы которых проводят электрический ток, называются электролитами. Вещества, водные растворы и расплавы которых не проводят электрический ток, называются неэлектролитами.
Растворы сахара, спирта, глюкозы электрический ток не проводят, а растворы солей, щелочей и кислот проводят электрический ток.

Шведский ученый Сванте Аррениус пришел к выводу еще в 1887 году, что вещества проводят электрический ток за счет ионов, которые образуются в результате растворения электролита в воде.
Этот процесс распада электролита на ионы при растворении или расплавлении называется электролитической диссоциацией.
Однако Аррениус считал, что в растворе находятся свободные ионы и не учитывал взаимодействие электролита с водой.
В отличие от него, русские химики И. А. Каблуков и В. А. Кистяковский, доказали, что при растворении электролита происходит взаимодействие растворённого вещества с водой, что приводит к образованию гидратов, которые затем распадаются на ионы. Т.е. в растворе находятся не свободные ионы, а гидратированные.
Легче всего диссоциируют, т.е. распадаются на ионы, вещества с ионным типом связи, т.к. они уже изначально состоят из ионов. При растворении таких веществ в воде, молекулы воды, которые представляют собой диполи, окружают отрицательные ионы своими положительными полюсами, а положительные ионы своими отрицательными полюсами. Между ионами и диполями воды возникают силы притяжения, при этом химическая связь между ионами ослабевает и происходит переход ионов из кристалла в раствор. Эти ионы находятся не в свободном состоянии, они связаны с присоединившимися к ним молекулами воды. Эти молекулы воды образуют гидратную оболочку иона. Ион в таком случае называется гидратированным. Например, при диссоциации хлорида натрия образуются ионы: ион натрия и ион хлора:
NaCl = Na+ + Cl-
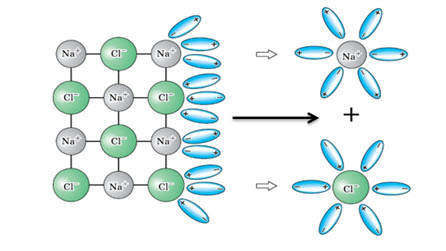
При диссоциации веществ с ковалентным полярным типом связи, например, при диссоциации хлороводорода – HCl, диполи воды также ориентируются своими отрицательными полюсами к положительному иону Н+, а своими положительными полюсами к отрицательно заряженному иону Cl-. Происходит взаимодействие молекул воды с молекулами электролита. Под влиянием воды происходит превращение ковалентной полярной связи в ионную, а затем распад электролита на гидратированные ионы:
HCl = H+ + Cl-

Последовательность процессов, происходящих при диссоциации веществ с ионной связью, будет состоять из трех стадий:
1. Ориентация диполей воды около иона кристалла.
2. Взаимодействие (гидратация) диполей воды с противоположно заряженными ионами кристалла.
3. Распад (диссоциация) кристалла на гидратированные ионы.
При диссоциации веществ с ковалентной полярной связью последовательность процессов состоит из 4 стадий:
1. Ориентация диполей воды вокруг противоположных полюсов электролита.
2. Взаимодействие (гидратация) молекул воды с молекулами электролита.
3. Ионизация молекул электролита, т.е. превращение ковалентной полярной связи в ионную.
4. Распад (диссоциация) молекул электролита на гидратированные ионы.
Если в растворе электролита происходит объединение гидратированных ионов, то этот обратный процесс называется ассоциация.
Свойства гидратированных и негидратированных ионов могут отличаться: негидратированный ион меди (Cu2+) бесцветный в безводных кристаллах сульфата меди (II), а в гидратированных ионах имеет голубой цвет (Cu2+ · nH2O).

В растворах электролитов помимо ионов присутствуют и молекулы, поэтому растворы электролитов характеризуются степенью диссоциации. Степень диссоциации обозначается греческой буквой «альфа» α.
Степень диссоциации – это отношение количества вещества электролита, распавшегося на ионы (nД), к общему количеству растворенного вещества (nР).
α = nД/nР
Степень диссоциации определяют опытным путем и выражают в долях или процентах. Ели α = 0, то диссоциация отсутствует, если α = 1, то электролит полностью диссоциирует на ионы.

Степень диссоциации зависит от:
· Природы растворителя. Например, водный раствор хлорида натрия обладает электропроводностью, т.к. вода – полярный растворитель, а бензольный раствор хлорида натрия не проводит электрический ток, т.к. бензол – неполярный растворитель. Следовательно, чем полярнее растворитель, тем больше степень диссоциации.
· Концентрации электролита: в разбавленных растворах она увеличивается, т.к. ионы больше отдаляются друг от друга, что мешает им связаться в молекулы.
· Температуры. Как правило, при повышении температуры увеличивается степень электролитической диссоциации.
· Природы самого электролита.
По степени диссоциации электролиты делятся на сильные и слабые. Сильные электролиты в растворах и расплавах почти полностью распадаются на ионы, степень их диссоциации стремится к единице. К сильным электролитам относятся: практически все соли, сильные кислоты, как H2SO4, HNO3, HCl, все щёлочи.

Слабые электролиты почти не распадаются на ионы в растворах и расплавах, степень их диссоциации стремится к нулю. К слабым электролитам относятся: вода, слабые кислоты, как H2S, HNO2, H2CO3 и др., водный раствор аммиака NH3 · H2O, нерастворимые основания.

 Получите свидетельство
Получите свидетельство Вход
Вход




 0
0 9782
9782

