1. При растворении в воде или расплавлении электролиты диссоциируют на ионы: положительные и отрицательные. Ионы – это положительно и отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в результате отдачи или присоединения электронов.
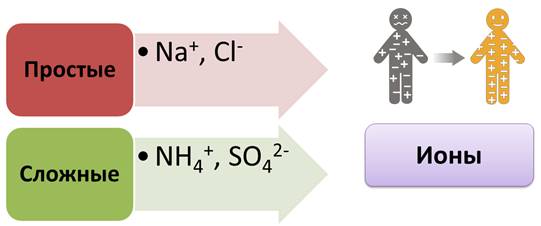
В растворах ионы беспорядочно передвигаются. В переводе с греческого «ион» означает «странствующий». По составу ионы делятся на простые: Na+, Cl-, и сложные: NH4+, SO42-.
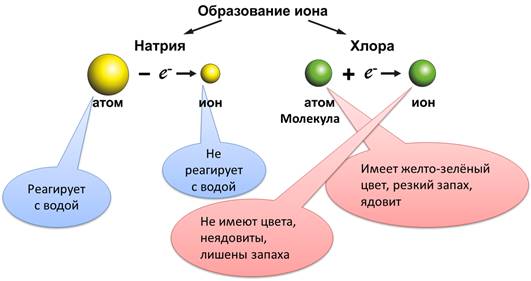
Ионы заметно отличаются от атомов этого же элемента. Так атомы натрия (Na0) энергично реагируют с водой с образованием щёлочи и водорода, а ион натрия (Na+) таких продуктов не образует. Хлор (Cl2) имеет желто-зелёный цвет, резкий запах, ядовит, а ионы хлора (Cl-) не имеют цвета, неядовиты, лишены запаха.
2. Причиной диссоциации электролита является его гидратация с молекулами воды и разрыв химической связи в нём.

В результате взаимодействия воды с молекулами воды образуются гидратированные ионы. Поэтому, по наличию водной оболочки ионы делятся на гидратированные (в растворах и кристаллогидратах) и негидратированные (в безводных солях).
3. Под действием электрического тока положительно заряженные ионы движутся к отрицательно заряженному полюсу источника тока – к катоду, поэтому их называют катионами, а отрицательно заряженные ионы движутся к положительно заряженному полюсу источника тока – аноду, поэтому их называют анионами.
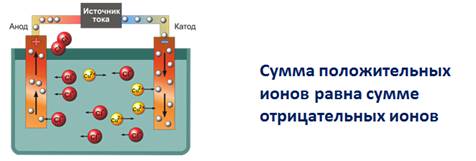
В растворах электролитов сумма положительных ионов (катионов) равна сумме отрицательно заряженных ионов (анионов), потому эти растворы электронейтральны.
4. Процесс диссоциации – обратимый процесс для слабых электролитов.
Наряду с процессом диссоциации, т.е. распадом электролита на ионы, в растворах слабых электролитов протекает обратный процесс – ассоциация, т.е. соединение ионов. Поэтому при диссоциации слабых электролитов в уравнении ставят не знак равенства, а знак обратимости.
HNO2 ⇆ H+ + NO2-
5. Не все электролиты в равной степени диссоциируют на ионы.
Поэтому электролиты делят на сильные, которые полностью диссоциируют на ионы в растворах и расплавах, степень их диссоциации стремиться к единице, и слабые, которые не полностью диссоциируют, степень их диссоциации стремится к нулю. Степень диссоциации зависит то природы электролита и его концентрации.
6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
По типу ионов, образующихся при диссоциации, различают три типа электролитов: кислоты, основания и соли. Кислоты при диссоциации образуют катионы водород и анионы кислотного остатка, основания – катионы металла и в качестве аниона – гидроксид-ионы, соли при диссоциации образуют катионы металла и анионы кислотного остатка.


 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 13388
13388

