Реакции между ионами называются ионными реакциями, а уравнения этих реакций – ионными уравнениями.

Основным из условий протекания ионных реакций является образование малодиссоциирующего вещества (слабого электролита), осадка или газа. Эти вещества записываются в молекулярном виде. Если выпадает осадок, то рядом с его формулой ставят стрелку, направленную вниз (↓), если образуется газ, то рядом с его формулой ставят стрелку, направленную вверх (↑).
Если к раствору хлорида натрия добавить раствор нитрата серебра, то образуется белый творожистый осадок хлорида серебра.
NaCl + AgNO3 = NaNO3 + AgCl↓
После записи молекулярного уравнения следует записать ионное уравнения, записав сильные электролиты в виде ионов, а образовавшийся осадок нужно записать в молекулярном виде. Две соли: хлорид натрия и нитрат серебра являются растворимыми и полностью распадаются на ионы, как и образующаяся соль – нитрат натрия, а хлорид серебра – осадок, поэтому его нужно записать в виде молекулы. Если вы забыли, как определяются заряды ионов, то нужно обратиться к таблице растворимости, в ней всегда указаны заряды ионов, а также по ней можно определить растворимо или нет вещество в воде.
Na+ + Cl- + Ag+ + NO3- = Na+ + NO3- + AgCl↓
Мы записали таким образом полное ионное уравнение. Если исключить из обеих частей равенства одинаковые ионы, т.е. ионы не участвующие в реакции – ионы натрия и нитрат-ионы в левой и правой части, то получится сокращенное ионное уравнение.
Ag+ + Cl- = AgCl↓
Это уравнение показывает, что сущность этой реакции сводится к взаимодействию ионов серебра и ионов хлора, в результате которого образуется осадок хлорида серебра.

Если мы к раствору гидроксида калия добавим несколько капель фенолфталеина, то раствор гидроксида калия окрасится в малиновый цвет. А затем сюда же прильем раствор серной кислоты, раствор станет бесцветным, следовательно, прошла химическая реакция.
2KOH + H2SO4 = K2SO4 + 2H2O
Чтобы записать полное ионное уравнение, нужно помнить, что вода – малодиссоциирующее вещество, поэтому её записываем в молекулярном виде.
2K+ + 2OH- + 2H+ + SO42- = 2K+ + SO42- + 2H2O
Т.к. ионы калия и сульфат-ионы в левой и правой части остаются неизменными, то их можно не записывать в сокращенном ионном уравнении.
2OH- + 2H+ = 2H2O
Все коэффициенты в сокращенном ионном уравнении можно сократить на два.
OH- + H+ = H2O
Таким образом, взаимодействие сильной кислоты и щёлочи сводится к тому, что взаимодействуют ионы водорода и гидроксид-ионы с образованием воды – малодиссоциирующего вещества.

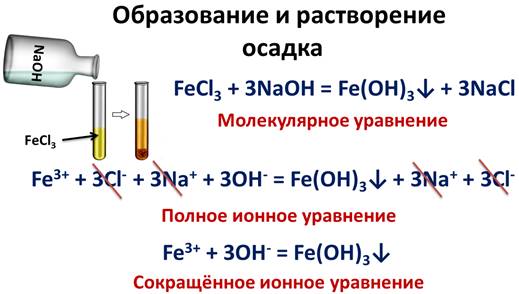
Если к раствору хлорида железа (III) добавить раствор щелочи, например, гидроксид натрия, то у нас образуется осадок – гидроксид железа (III).
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
Записав полное ионное уравнение, мы видим, что ионы натрия и хлорид-ионы не участвуют в реакции, значит, их можно исключить, а в сокращенном ионном уравнении записать только ионы железа и гидроксид-ионы, которые участвуют в реакции с образованием осадка.
Fe3+ + 3Cl- + 3Na+ + 3OH- = Fe(OH)3↓ + 3Na+ + 3Cl-
Fe3+ + 3OH- = Fe(OH)3↓
Поделим полученный осадок на три части, к одной части прильем раствор серной кислоты, ко второй – раствор соляной кислот, к третьей – раствор азотной кислоты. Осадок растворится в трёх случаях, т.е. прошла химическая реакция.
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Если в раствор карбоната натрия добавить соляной кислоты, то происходит «вскипание» раствора, вследствие образования углекислого газа. В нашем случае образуется угольная кислота, которая распадается на углекислый газ и воду.
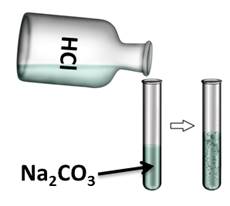
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
При записи полного ионного уравнения помните, что газ и вода записываются в молекулярном виде.
2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ + 2Cl- + CO2↑ + H2O
Ионы натрия и хлорид-ионы не участвуют в реакции, поэтому в сокращенном ионном уравнении их можно не записывать.
CO32- + 2H+ = CO2↑ + H2O

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 16905
16905

