Понятие о спиртах
Спирты – это органические вещества, в молекулах которых углеводородный радикал связан с гидроксильной группой – ОН.
Число гидроксильных групп – ОН в молекуле определяет атомность спирта. Если в молекуле спирта одна группа ОН, значит это одноатомный спирт, если две группы ОН, значит это двухатомный спирт, если три группы ОН, то это трёхатомный спирт.
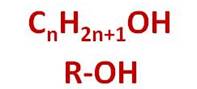
Общая формула спиртов CnH2n+1OH, или R–OH, где R – это углеводородный радикал.
Запомни, друг, и я и ты:
В них углерод и гидроксид,
И каждый спирт легко горит.
R – это значит: радикал,
Насыщенный иль непредельный.
Он может быть велик и мал,
Но это разговор отдельный…
Названия одноатомных спиртов образуются от названий соответствующих углеводородов с прибавлением суффикса – ол.

Спирты, имеющие от одного до одиннадцати атомов углерода находятся в жидком агрегатном состоянии, начиная с двенадцати атома углерода – это спирты представляющие собой твёрдые вещества. Первые три представителя спиртов имеют алкогольный запах, они бесцветны и хорошо растворимы в воде. Среди спиртов отсутствуют газы из-за наличия водородных связей, кроме этого водородная связь обуславливает более высокие температуры кипения спиртов по сравнению с углеводородами с тем же числом атомов углерода.
Рассмотрим спирт метанол и этанол.
Метанол, или метиловый спирт CH3OH представляет собой бесцветную жидкость, кипит при температуре 64,70C. С водой смешивается в любых соотношениях, имеет своеобразный запах. Метанол чрезвычайно ядовит, опасны и его пары. Метанол является ядом нервно-паралитического действия, употребление небольшой его дозы приводит к потере зрения и даже смерти человека.


Метиловый спирт впервые был получен при сухой перегонке древесины. По этой причине его ещё называют древесным спиртом.


Формулу древесного спирта установил французский химик Дюма в 1834 году и только через двадцать пять лет метиловый спирт был получен синтетическим путём.


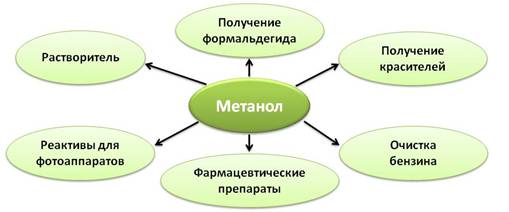
Горит метанол бесцветным пламенем. Его используют как растворитель, для получения формальдегида, красителей, реактивов для фотоаппаратов, получения фармацевтических препаратов и для очистки бензина.
Этанол, или этиловый спирт C2H5OH представляет собой бесцветную жидкость со слабым запахом и жгучим вкусом. Он легче воды и обладает характерным алкогольным запахом. Этанол – летучая жидкость. Его температура кипения 78,30C. Смешивается с водой во всех соотношениях и является хорошим растворителем.

Этиловый спирт – наркотик. При приёме внутрь он быстро всасывается в кровь, проникая в головной мозг, спирт действует на нервные клетки и вызывает опьянение. Под влиянием спиртного у человека ослабляет внимание, затормаживается реакция, изменяется поведение. Употребление спиртных напитков приводи к тяжёлому заболеванию – алкоголизму.

Химические свойства спиртов обусловлены наличием в них функциональных групп – OH.
Таким образом, функциональная группа – это группа атомов, определяющая наиболее характерные свойства классов органических соединений.
Атом водорода при группе OH очень подвижный, поэтому спирты проявляют слабые кислотные свойства.

По этой причине спирты вступают в химические реакции с активными металлами. В результате взаимодействия этанола с натрием образуется соединение – этилат натрия и водород. Продукты замещения атома водорода гидроксильной группы на атом металла называют алкоголятами.

Термин «алкоголи» предложил в девятнадцатом веке Берцэлиус, что в переводе с арабского означает «тонкий порошок», который образуется при выпаривании раствора.


Для спиртов характерны реакции окисления. Например, при окислении этанола образуется уксусный альдегид. Эту реакцию иллюстрирует следующий опыт. Накалим медную проволоку на пламени спиртовки. На проволоке образуется чёрный налёт. Затем опустим эту проволоку в пробирку с этиловым спиртом. Чёрный налёт растворяется и проволока опять приобретает прежний вид. Кроме этого, изменяется и запах, потому что этиловый спирт окислился до альдегида, имеющего специфический запах.

При полном окислении этанола образуется углекислый газ и вода. Он легко воспламеняется и горит слабо светящимся голубоватым пламенем.

При взаимодействии спиртов с галогеноводородами образуются галогеналканы. Например, в реакции этанола с бромоводородом образуется бромэтан и вода.
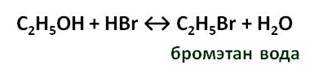
В промышленности этанол получают реакцией гидратации этилена в присутствии серной кислоты.

Таким методом получают технический этиловый спирт, который содержит примеси метилового спирта. Пищевой этиловый спирт получают ферментативным расщеплением сахаристых веществ.
Ректификат – этиловый спирт, содержащий четыре с половиной процента воды, а абсолютный спирт – это безводный спирт. Денатурат – это этанол, содержащий цветные и дурнопахнущие вещества.
Этиловый спирт, в громадных количествах, используется для технических нужд. Его применяют как растворитель в лакокрасочной и химико-фармацевтической промышленности, для синтеза красителей и синтетического каучука, получения пластмасс, духов, при консервировании анатомических препаратов, для получения уксусной кислоты, антифризов, взрывчатых веществ, бытовой химии.

Особенно большое значение этиловый спирт приобрёл после того, как в 1930 году химик Лебедев открыл способ производства каучука из этанола.

Этиловый спирт используют в медицине для компрессов, обтираний, дэзинфекции кожи перед уколом.
Его широко применяют для изготовления настоек и экстрактов, а также для лекарств. Этиловый спирт – основное сырьё ликёроводочных и винных производств.
Для получения этилового спирта используют также реакцию брожения сахаристых веществ.
При брожении глюкозы образуется этанол и углекислый газ.

Рассмотрим многоатомные спирты: двухатомный спирт этиленгликоль и трёхатомный спирт – глицерин.
Этиленгликоль – бесцветная густая жидкость, тяжелее воды. Кипит при температуре 1970C, замерзает при температуре 130C. Он ядовит и имеет сладкий вкус. Этиленгликоль не имеет запаха и смешивается с водой в любых соотношениях, он гигроскопичен.


Этиленгликоль применяют в качестве антифризов, для получения лавсана и взрывчатых веществ.
Трёхатомный спирт – глицерин представляет собой сиропообразную бесцветную жидкость со сладким вкусом, температура кипения 2900C, температура замерзания -170C. Глицерин хорошо растворим в воде и гигроскопичен.

Глицерин открыл знаменитый шведский химик Шееле в 1779 году. Он нагревал оливковое масло с кислотой и получил мазь, которая оказалась сладкой на вкус. Из мази Шееле выделил вязкую жидкость, которую назвал масляный сахар. Это и был глицерин.


Глицерин применяется в кожевенной промышленности, водные растворы глицерина используют в качестве антифризов, для производства взрывчатых веществ, в текстильной и пищевой промышленности, в фармацевтической и косметической промышленности.
Качественной реакцией на многоатомные спирты является реакция со свежеприготовленным гидроксидом меди (II). Сначала нужно получить гидроксид меди (II). Для этого к раствору гидроксида натрия прильём раствор медного купороса, в результате у нас образуется осадок голубого цвета – это гидроксид меди (II).
![]()
После этого, к этому осадку добавим глицерин, осадок растворяется и раствор приобретает ярко-синий цвет.
Таким образом, спирты содержат функциональную группу – ОН, метанол и этанол – представители насыщенных одноатомных спиртов. Характерные свойства спиртов определяются наличием в их молекулах функциональной группы – ОН. Этанол и метанол широко используются во многих отраслях промышленности. Представителями многоатомных спиртов являются этиленгликоль и глицерин. Качественной реакцией на многоатомные спирты является реакция с гидроксидом меди (II). Этиленгликоль и глицерин используют также во многих отраслях производства.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 6595
6595

