Из повседневного опыта мы знаем, что жидкости, например вода, находясь в открытых сосудах, с течением времени переходят в газообразное состояние. Такой процесс в физике называется парообразованием.
Переход вещества из жидкого состояния в газообразное возможен двумя различными процессами: испарением и кипением.
Под испарением мы с вами будем понимать процесс парообразования, происходящий со свободной поверхности жидкости, граничащей с газообразной средой или вакуумом.
Рассмотрим процесс испарения с точки зрения молекулярно-кинетической теории вещества. Но для начала давайте вспомним, что молекулы вещества в любом его агрегатном состоянии находятся в непрерывном движении. Их скорости меняются самым случайным образом. И несмотря на то, что среднее значение кинетической энергии молекул при заданной температуре имеет определённое значение, кинетическая энергия отдельной молекулы может быть как больше, так и меньше средней:
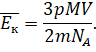
Наиболее быстрые молекулы, находящиеся в верхних слоях жидкости, могут преодолеть силы притяжения к другим молекулам и покинуть жидкость. А так как молекулы с большой энергией есть всегда, то со временем количество жидкости будет уменьшаться, а над жидкостью будет образовываться пар.
Поскольку при испарении поверхность жидкости покидают самые быстрые молекулы, то средняя кинетическая энергия оставшихся молекул уменьшается, и в результате температура жидкости понижается.

Скорость испарения жидкости зависит от многих факторов: от её рода, температуры, площади свободной поверхности и от притока воздуха.
Вылетевшая из жидкости молекула принимает участие в беспорядочном тепловом движении газа. Хаотично двигаясь, она может навсегда удалиться от поверхности жидкости, находящейся в открытом сосуде, а может и вернуться снова в жидкость.
Процесс превращения пара в жидкость называется конденсацией. При этом процессе число молекул, возвращающихся в жидкость за определённый промежуток времени, всегда больше числа молекул, покидающих её.
Процессы испарения и конденсации широко распространены в природе и технике. Так, например, вследствие испарения воды с поверхности водной оболочки Земли — гидросферы, с поверхности почвы и растительного покрова в воздухе всегда находятся водяные пары, которые могут конденсироваться, образовывать облака и выпадать в виде осадков.

Над свободной поверхностью жидкости всегда имеются пары этой жидкости. И если сосуд с жидкостью не закрыт, то концентрация частиц пара при постоянной температуре может изменяться достаточно в широких пределах как в сторону уменьшения, так и в сторону увеличения.
Однако процесс испарения в замкнутое пространство при данной температуре может происходить только до определённого предела. Объясняется это достаточно просто. Вот есть сосуд, который частично заполнили водой и плотно закрыли. В сосуде одновременно протекают два противоположно направленных процесса — это испарение и переход водяного пара в жидкость, то есть конденсация.
В течение некоторого промежутка времени после герметизации сосуда испарение жидкости преобладает над конденсацией её пара. Количество жидкости в сосуде будет уменьшаться, а плотность пара над ней — увеличиваться. Но концентрация пара в закрытом сосуде не может расти вечно. Со временем число молекул, покидающих жидкость, станет равным числу молекул, возвращающихся в неё, за тот же промежуток времени. В этом случае говорят, что между жидкостью и паром устанавливается состояние динамического равновесия.
Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называют насыщенным.
А теперь давайте нагреем наш сосуд, в котором жидкость и пар находятся в состоянии динамического равновесия. Нетрудно заметить, что при увеличении температуры, количество молекул, которые покидают поверхность жидкости, возрастает. При этом в начале количество молекул, покидающих жидкость, больше, чем тех, которые возвращаются обратно, то есть нарушается динамическое равновесие. Однако через какое-то время равновесие вновь восстанавливается. Но так как число молекул в единице объёма пара увеличилось по сравнению с первоначальным, то увеличилась и плотность насыщенного пара. А мы уже знаем, что при увеличении плотности газа возрастает и его давление.
Значит, с увеличением температуры, плотность и давление насыщенного пара увеличиваются. Приближённо зависимость давления насыщенного пара от температуры можно описать уравнением состояния идеального газа:
p = nkT.
Почему приближённо? Дело в том, что давление насыщенного пара при постоянном объёме растёт не только вследствие повышения температуры жидкости, но и вследствие увеличения концентрации молекул пара и, как следствие, его плотности и массы.
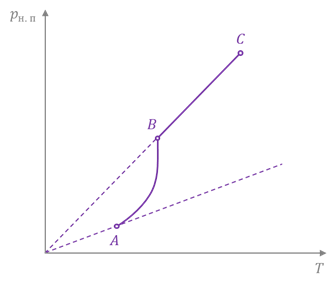
Поэтому вначале давление насыщенного пара растёт быстрее, чем давление идеального газа. И лишь когда вся жидкость испарится, пар перестанет быть насыщенным и его давление при постоянном объёме будет расти прямо пропорционально температуре.
Вернём нашу систему в исходное состояние и посмотрим, как поведёт себя насыщенный пар, если уменьшить занимаемый им объём. Сразу при уменьшении объёма пара его давление увеличивается, что тут же приводит к возрастанию количества молекул, переходящих в жидкость, и динамическое равновесие нарушается. Но вот число молекул, которые покидают поверхность жидкости, не меняется, так как оно зависит только от температуры, которая у нас остаётся неизменной. В результате количество молекул пара уменьшается. Этот процесс продолжается до тех пор, пока вновь не установится динамическое равновесие и плотность пара, а, следовательно, его давление и концентрация молекул не примут своих прежних значений.
Таким образом, при постоянной температуре давление и плотность насыщенного пара не зависят от занимаемого им объёма.
Давление и плотность насыщенного пара при данной температуре — это максимальные давление и плотность, которое может иметь пар, находящийся в состоянии динамического равновесия со своей жидкостью при этой температуре.
Пар, давление (или плотность) которого меньше давления (или плотности) насыщенного пара при той же температуре, называют ненасыщенным паром.
При уменьшении объёма давление ненасыщенного пара увеличивается подобно тому, как изменяется давление при уменьшении объёма идеального газа. Достигнув определённого объёма, пар становится насыщенным, и при дальнейшем сжатии будет происходить превращение пара в жидкость. А как только весь пар превратится в жидкость, дальнейшее уменьшение объёма вызовет резкое увеличение давления, так как жидкости малосжимаемы.
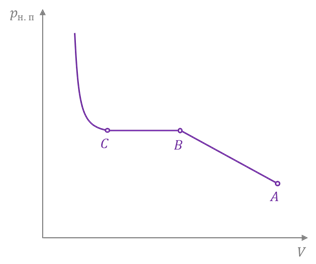
Но самое интересное в этом то, что если температура пара выше некоторого значения, то, как бы мы ни сжимали его, он никогда не превратится в жидкость. То есть превращение пара в жидкость происходит не при любой температуре. Максимальная температура, при которой пар ещё может превратиться в жидкость, называется критической температурой.
У каждого вещества своя критическая температура.
Запомните, что состояние вещества при температуре выше критической называется газом; при температуре ниже критической, когда у пара есть возможность превратиться в жидкость, — паром.
Обобщив всё вышесказанное, можно утверждать, что газовые законы для насыщенного пара не применимы, так как при любом объёме при постоянной температуре давление насыщенного пара одинаково. Однако состояние насыщенного пара достаточно точно описывается уравнением Клайперона — Менделеева.
А теперь давайте посмотрим, как будет происходить испарение жидкости, если к ней постоянно подводить теплоту. Возьмём сосуд с водой и установим под него какой-нибудь нагреватель (например, спиртовку или электроплитку). С помощью термометра будем следить за показаниями температуры в сосуде. Понаблюдаем за жидкостью. Как видим, по мере роста температуры на дне сосуда появляется множество пузырьков. Это растворённый в жидкости газ, который всегда присутствует в жидкости, и степень растворения которого понижается с ростом температуры. При нагревании жидкости снизу газ начинает выделяться в виде пузырьков у дна и стенок сосуда.

В эти пузырьки происходит испарение жидкости. Поэтому в них, кроме воздуха, находится насыщенный пар, давление которого с ростом температуры быстро увеличивается, и пузырьки растут в объёме, а следовательно, увеличиваются действующие на них силы Архимеда. Когда выталкивающая сила станет больше силы тяжести пузырька, он начинает всплывать. Но пока жидкость не будет равномерно прогрета, по мере всплытия объём пузырька уменьшается. Давление стремительно падает, и, не достигнув свободной поверхности, пузырьки исчезают (захлопываются). Этот процесс происходит настолько быстро, что стенки пузырька, сталкиваясь, производят нечто вроде взрыва. Вот почему мы слышим характерный шум перед закипанием воды.
Когда температура жидкости выровняется, объём пузырька при подъёме будет возрастать, так как давление насыщенного пара не изменяется, а внешнее давление на пузырёк, представляющее собой сумму гидростатического давления жидкости, находящейся над пузырьком, и атмосферного давления, уменьшается. Пузырёк достигает свободной поверхности жидкости, лопается, и насыщенный пар выходит наружу — жидкость закипает.
Кипение — это процесс парообразования, происходящий по всему объёму жидкости.
Температура, при которой происходит кипение жидкости, называется температурой кипения.
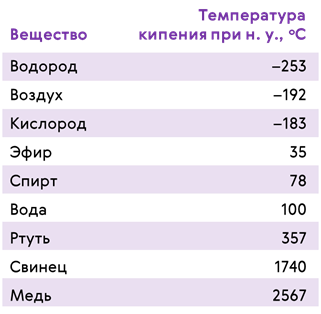
Конечно же, температура кипения у разных жидкостей различна. Это и понятно, ведь различна энергия взаимодействия их молекул. В таблице, которую вы сейчас видите на экране, приведены температуры кипения жидкостей при нормальном атмосферном давлении. А как выдумаете, случайно ли мы, говоря о температуре кипения жидкости, указываем давление?
Конечно же, неслучайно. Пузырьки кипящей жидкости лопаются при условии, что давление пара в них не меньше, чем давление снаружи. Значит, чем меньше внешнее давление, тем при более низкой температуре закипит жидкость. И наоборот.
Для подтверждения наших слов, проведём такой опыт. Возьмём три сосуда с водой, находящихся в герметичных камерах. Тепло к сосудам будем подводить при помощи электрических нагревателей, а температуру измерять термометрами. Пусть во второй камере давление воздуха составляет одну атмосферу, в первой камере мы снизим давление в два раза, откачав воздух. А в третьей камере мы давление воздуха увеличим до пяти атмосфер.
Включи́м плитки и пронаблюдаем за жидкостями. Первой у нас закипает вода в первой камере. При этом обратите внимание: кипит она при температуре всего 81 оС. Вода в камере с нормальным давлением, как и ожидалось, закипела при 100 оС.
А что же в камере номер три? Вода кипит в ней при температуре более 151 оС.
Таким образом, мы показали, что действительно чем меньше внешнее давление, тем при более низкой температуре закипит жидкость, и наоборот.
Если же предварительно освободить жидкость от растворенного в ней газа, то её можно перегреть, то есть нагреть выше температуры кипения. Это неустойчивое состояние жидкости. Достаточно небольших сотрясений и жидкость закипает, а её температура сразу понижается до температуры кипения.

 Получите свидетельство
Получите свидетельство Вход
Вход





 14044
14044

