На прошлом уроке мы с вами познакомились с уравнением состояния идеального газа — уравнением Клайперона — Менделеева, которое связывает макропараметры газа в состоянии теплового равновесия. Это уравнение справедливо для любой массы газа и связывает между собой параметры одного его состояния. Использование уравнения Клайперона — Менделеева позволяет описать различные процессы, происходящие в идеальном газе, в которых масса газа, его химический состав и один из трёх макропараметров остаются неизменными. Процессы, протекающие при фиксированном значении одно из макропараметров, называют изопроцессами (с греческого, изос (ἴσος) переводиться как 'равный', 'одинаковый').
А количественные зависимости между двумя параметрами газа при неизменном значении третьего называют газовыми законами. Интересно, но открыты газовые законы были задолго до создания молекулярно-кинетической теории идеального газа.
Самым первым из изопроцессов в газе был изучен процесс при постоянной температуре. Он получил название изотермический (с греческого те́рми (θέρμη) переводиться, как 'теплота'). В 1662 году английский учёный Роберт Бойль и независимо от него в 1676 году француз Эдм Мариотт установили, что при постоянной температуре, неизменной массе и неизменном химическом составе газа произведение давления на объём есть величина постоянная:

И действительно, если масса идеального газа, его молярная масса и температура не изменяются, а универсальная газовая постоянная и так постоянная величина, то правая часть уравнения Клапейрона — Менделеева будет являться константой.

Справедливость закона Бойля — Мариотта можно проверить на таком опыте. Возьмём герметичный гофрированный сосуд, соединённый с манометром. Винт, находящийся в верхней части сосуда, позволяет менять его объём, который измеряется при помощи линейки. А постоянство температуры газа в сосуде будем поддерживать при помощи термостата (устройство, для поддержания постоянной температуры). В качестве термостата будем использовать обычную воду, так как у неё достаточно высокая удельная теплоёмкость.
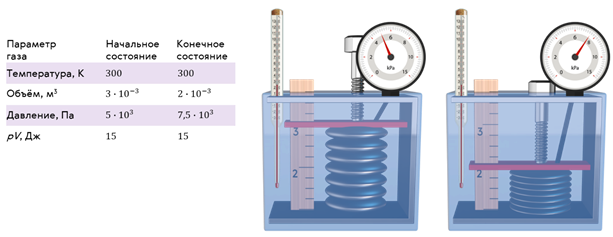
Теперь при помощи винта уменьшим объём газа в сосуде, тем самым увеличив его давление и немного подождём, чтобы система пришла в равновесное состояние. Равновесным называется такое состояние системы, при котором температура и давление во всех точках объёма одинаковы. А процесс, при котором все промежуточные состояния газа являются равновесными, называют равновесным процессом.
Как видим, несмотря на то, что объём и давление газа изменились, их произведение осталось таким же, как и в начальном состоянии.
Опыты показали, что реальные газы подчиняются закону Бойля — Мариотта тем точнее, чем меньше их плотность. Однако при значительном увеличении давления (в несколько сот раз больше атмосферного) этот закон перестаёт выполняться.
Для наглядного изображения изменений состояния газа при изотермическом процессе удобно использовать так называемую p — V-диаграмму, на которой по оси абсцисс откладываются значения объёма, а по оси ординат — давления.

График зависимости давления газа от объёма при постоянной температуре называется изотермой. Она представляет собой гиперболу, так как из закона Бойля—Мариотта следует, что давление газа обратно пропорционально температуре. При этом, чем больше температура газа, тем выше будет лежать изотерма.
В 1787 году французский учёный Жак Шарль занялся изучением процесса изменения состояния газа при постоянном объёме. Такой процесс называется изохорным (от греческого хо́рос (χώρος) — ‘место’). Рассмотрим упрощённую схему опытов Шарля. Вот у нас есть колба с воздухом, которая соединена с манометром и находится в тепловом равновесии с жидкостью в сосуде. Начнём нагревать жидкость. Не трудно заметить, что с ростом температуры давление воздуха в колбе увеличивается.

Если же прекратить нагрев воды в сосуде, то её температура начнёт падать и, как следствие, начнёт уменьшаться давление газа в колбе. Объяснить эту зависимость можно на основании уравнения Клайперона — Менделеева:

Соберём изменяющиеся в ходе опыта величины в одной части уравнения, а все константы — в другой:
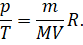
Отсюда вытекает закон, экспериментально установленный Шарлем: если при переходе из начального состояния в конечное масса и молярная масса газа не изменяются, то отношение давление газа к температуре остаётся постоянным:
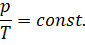
В координатах рТ график изохорного процесса для идеального газа, масса и молярная масса которого постоянны, представляет собой прямую линию, продолжение которой проходит через начало координат. Эту линию называют изохорой.

Обратите внимание на то, что все изохоры сходятся в точке нулевого значения температуры, но изображены они там пунктирными линиями. Дело в том, что при низких температурах все газы начинают существенно отличаться от модели «идеальный газ» и при уменьшении температуры превращаются в жидкости.
Естественно, что разным объёмам соответствуют разные изохоры. Давайте проведём на графике произвольную изотерму. Не трудно заметить, что с ростом объёма газа при постоянной температуре давление его, согласно закону Бойля— Мариотта, падает. Поэтому изохора, соответствующая большему объёму, лежит ниже изохоры, соответствующей меньшему объёму.
И нам осталось ещё изучить процесс, протекающий при постоянном давлении. Он называется изобарным процессом (от греческого ба́рос (βάρος) — 'тяжесть'). Впервые он был рассмотрен в 1802 году французским учёным Жозефом Гей-Люссаком. В ходе серии опытов учёный установил, что если при переходе из начального состояния в конечное масса газа и его химический состав не изменяются, то отношение объёма газа к температуре остаётся постоянным:

И несмотря на то, что закон Гей-Люссака был открыт экспериментальным путём, он достаточно просто выводится из уравнения состояния идеального газа:

Справедливость закона Гей-Люссака можно проверить на таком опыте. Возьмём сосуд, наполненный жидкостью, которая находится в тепловом равновесии с тонкой трубкой, заполненной воздухом, запертым столбиком масла. При увеличении температуры жидкости объём воздуха, находящегося в трубке под столбиком масла, возрастает. А при уменьшении температуры — уменьшается.

Поскольку при постоянном давлении объём газа пропорционален температуре, то график зависимости объёма газа от температуры представляет собой прямую линию, продолжение которой проходит через начало координат. Эту линию называют изобарой. Проведём на рисунке произвольную изотерму. Теперь вспомним, что согласно закону Бойля — Мариотта с ростом давления объём газа уменьшается. Поэтому изобара, соответствующая более высокому давлению, лежит ниже изобары, соответствующей более низкому давлению.

Как и в случае изохорного процесса, изобара реального газа не может быть продлена до нулевого значения температуры.

 Получите свидетельство
Получите свидетельство Вход
Вход




 8488
8488

