Алкены. Химические свойства этилена
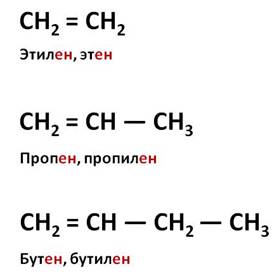
Первым представителем алкенов является этилен, или этен. Его молекулярная формула С2Н4. Из этой формулы можно выразить общую формулу этого класса – CnH2n.
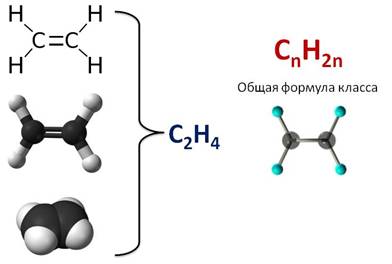
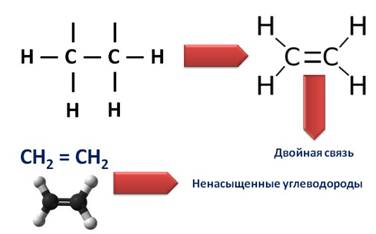
В образовании молекулы этилена участвуют два атома углерода, с каждым атомом углерода соединено два атома водорода и ещё у каждого атома углерода остаётся по одной свободной валентности, ведь атомы углерода должны быть четырёхвалентны. Поэтому между этими двумя углеродами возникает ещё одна связь. Такую связь называют двойной.
Из-за этой двойной связи этилен относят к ненасыщенным углеводородам, потому что атомы углерода не насыщены до предела атомами водорода, а образуется двойная C – C связь.
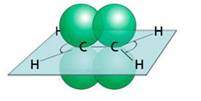
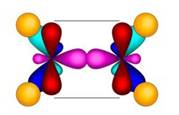
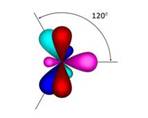
Молекула этилена плоская. Все шесть атомов молекулы лежат в одной плоскости. Экспериментально установлено, что валентные углы в молекуле этилена приблизительно равны 1200.
Вторым представителем гомологического ряда алкенов является пропен, или пропилен. Как вы могли заметить, в названии свех алкенов употребляется суффикс – ен. Следующим представителем алкенов является бутен, или бутилен.
По физическим свойствам этилен – газ со слабым запахом, незначительно растворяется в воде, лучше – в органических растворителях.
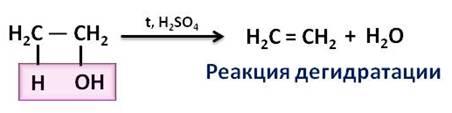
В лаборатории этилен можно получить из этилового спирта, путём отщепления от него молекулы воды. Эта реакция протекает в присутствии серной кислоты и при нагревании.
Эта реакция является реакцией дэгидратации. То есть, реакции дэгидратации – это реакции разложения, в результате которых от молекул веществ отщепляется вода.

Если поджечь выделяющийся газ, то можно заметить, что этилен горит светящимся пламенем.
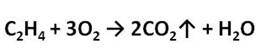
Этилен в промышленности получают нагреванием при высокой температуре углеводородов, содержащихся в попутных газах нефти. Эта реакция – крекинг (от английского крэк – расщеплять).
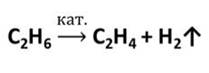
Этилен применяют для получения пластмасс и полиэтилена.
Полиэтилен – распространённый материал, из которого изготавливают трубы, посуду, его используют как покрытие для теплиц, как упаковку для сельхозпродуктов и продуктов питания, изготовления одноразовой посуды. Этилен используют для получения этилового спирта и других растворителей.
Полиэтилен получают из этилена при высокой температуре и давлении.
Эта реакция называется реакцией полимеризации. То есть, реакции полимеризации – это реакции, в которых происходит соединение молекул исходного вещества в огромную молекулу.
Исходное вещество, которое вступает в реакцию полимеризации, называется мономером. В данном случае, это – этилен, а продукт реакции – это полимер, у нас это – полиэтилен.
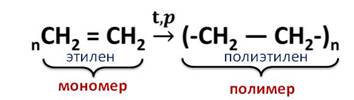
Полимеризацию можно рассматривать как частный случай реакции присоединения.
Для алкенов характерны и другие реакции присоединения. Эти реакции протекают с разрывом одной из двух связей.
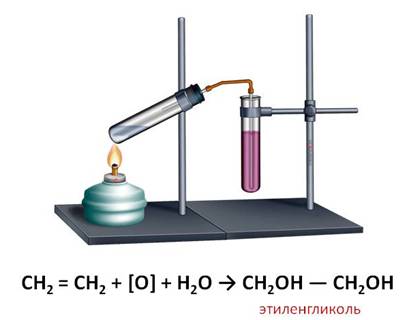
Например, реакция присоединения воды, которая называется реакцией гидратации.
В результате реакции гидратации этилена образуется спирт – этанол. Эта реакция протекает в присутствии катализатора.
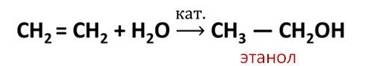
Этанол, или этиловый спирт широко используется как растворитель, для производства каучуков, пластмасс и химических волокон.
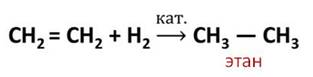
Водород присоединяется к этилену в присутствии катализатора с образованием этана. В этой реакции разорвалась одна химическая связь в молекуле этилена и связь в молекуле водорода и образовались две новые связи Н – С в молекуле этана.
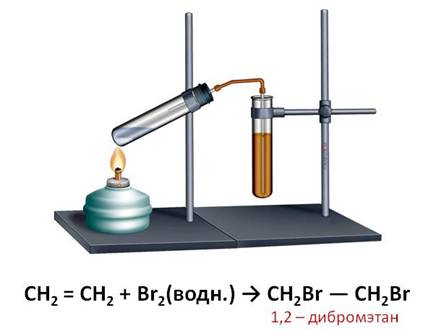
С помощью реакций присоединения можно распознать алкены. Качественными реакциями на двойную связь являются реакции обесцвечивания ими бромной воды и водного раствора перманганата калия.
Например, если пропустить через раствор бромной воды этилен, то происходит обесцвечивание бромной воды. В результате данной реакции образуется соединение – 1,2 – дибромэтан – вещество, у которого отсутствуют кратные связи.
Если пропустить газ этилен через раствор марганцовки, то в данном случае, также происходит обесцвечивание этого раствора. В результате данной реакции образуется этиленгликоль.
Таким образом, молекула этилена имеет плоскостное строение, то есть все атомы находятся в одной плоскости. Валентный угол равен 1200. Характерными реакциями этилена являются реакции присоединения. Качественными реакциями на этилен являются реакции обесцвечивания бромной воды и водного раствора перманганата калия.

 Получите свидетельство
Получите свидетельство Вход
Вход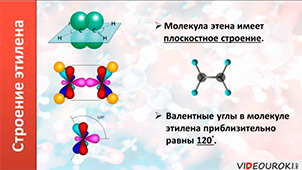



 1
1 21141
21141


как посмотреть видео?