Ацетилен
Впервые ацетилен получил в 1836 году Дэви, действуя на карбид кальция водой. Дал название ацетилену французский химик – П.Э. Бертло в 1860 году.


Ацетилен, или этин является первым представителем ненасыщенных углеводородов с тройной связью. Его молекулярная формула С2Н2. Начиная с ацетилена, можно построить гомологический ряд, в котором каждый последующий углеводород отличается от предыдущего на одну группу СН2.
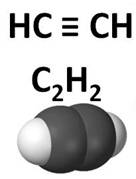
С3Н4 – это пропин, С4Н6 – бутин. Поэтому общая формула гомологического ряда ненасыщенных углеводородов с одной тройной связью СnНn-2. Общее название этого класса – алкины.
Названия ацетилена и его гомологов образуют изменением суффикса – ан на суффикс –ин.
В отличие от этилена, имеющего плоскостное строение, ацетилен имеет линейное строение: все четыре атома молекулы ацетилена лежат на одной прямой с углами связей, равными 1800. Каждый атом углерода образует три связи с атомами углерода и одну – с атомами водорода.

Ацетилен при обычных условиях представляет собой бесцветный газ, смесь которого с воздухом взрывается от искры. Ацетилен плохо растворяется в воде, хорошо растворяется в ацетоне: в одном объёме ацетона при обычных условиях растворяется двадцать пять объёмов ацетилена.
Так как ацетилен содержит кратные связи, то для него характерны реакции присоединения. Например, при присоединении водорода количеством один моль к ацетилену количеством один моль в присутствии катализатора образуется этилен.
В данной реакции происходит разрыв только одной ковалентной связи в молекуле ацетилена.
Этилен, в свою очередь, также может взаимодействовать с водородом в присутствии катализатора с образованием этана. Поэтому можно написать суммарное уравнение присоединения водорода количеством два моль к ацетилену количеством один моль с разрывом двух ковалентных связей и образованием этана.
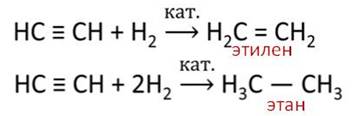
Ацетилен вступает и в реакции присоединения галогенов.
Например, при присоединении хлора количеством 1 моль к ацетилену количеством один моль, разрывается одна ковалентная связь и образуется 1,2–дихлорэтен, если к ацетилену присоединить сразу два моль хлора, то разрывается две ковалентные связи и образуется соединение 1,1,2,2–тэтрахлорэтан.
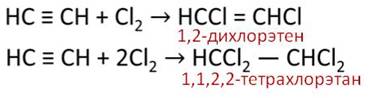
Кроме галогенов, ацетилен вступает в реакции присоединения галогеноводородов. Например, при присоединении хлороводорода количеством один моль к ацетилену количеством один моль, то разрывается только одна ковалентная связь и образуется хлорэтен. Если к ацетилену количеством один моль добавить два моль хлороводорода, то разрываются две связи и образуется 1,1–дихлорэтан.
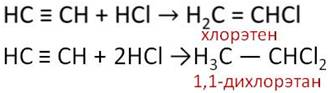
При горении ацетилена образуется углекислый газ и вода.


В лаборатории ацетилен получают действием воды на карбид кальция СаС2. В результате этого взаимодействия образуется ацетилен и гидроксид кальция.
Например, если на карбид кальция подействовать водой, а затем поджечь выделяющийся газ, то он горит коптящим пламенем. Это горит ацетилен.

В смеси с кислородом ацетилен широко используется для резки и сварки металлов. Ацетилен используют при получении растворителей, уксусной кислоты, клея ПВА, поливинилхлорида, а также его используют как горючее.

Решим задачу. Вычислите, какой объём ацетилена при нормальных условиях, образуется в результате взаимодействия с водой 100 г технического карбида кальция, содержащего 4% примесей.
По условию задачи нам дана масса карбида кальция 100 г и массовая доля примесей в этом техническом карбиде кальция 4%. Найти нужно объём ацетилена. Согласно уравнению, в результате этой реакции образуется газ ацетилен и гидроксид кальция. Найдём массовую долю чистого карбида кальция, для этого от 100 вычитаем 4 и получаем 96%, поэтому масса чистого карбида кальция равна произведению массы технического карбида кальция на массовую долю чистого карбида кальция. Получается нужно 100 умножить на 0,96%, получаем 96 г. Нам необходимо найти количество вещества карбида кальция, для этого необходимо его массу разделить на молярную массу. Чтобы найти молярную массу карбида кальция нужно атомную массу кальция умножить на один и сложить с произведением атомной массы углерода, умноженной на два, получается 64 г/моль. Находим количество вещества карбида кальция, для этого разделим массу на молярную массу, подставим значения: 96 г делим на 64 г/моль, получаем 1,5 моль. Найдём по уравнению реакции количество вещества ацетилена, для этого 1,5 умножим на 1 и разделим на 1, будет 1,5 моль. Теперь можно найти и объём ацетилена, для этого необходимо количество вещество умножить на молярный объём. Получается 1,5 моль умножим на 22,4 л/моль, будет 33,6 л. Поэтому, в результате данной реакции образуется 33,6 л ацетилена.

Таким образом, ненасыщенные углеводороды с одной тройной связью (алкины) образуют гомологический ряд общей формулой СnНn-2. Названия ацетилена и его гомологов образуют изменением суффикса –ан на суффикс –ин. Ацэтилен имеет линейное строение и образует угол связи равный 1800. Характерными свойствами ацетилена являются реакции присоединения.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 10476
10476

