Алканы. Свойства. Строение и применение
Алканы – предельные или насыщенные углеводороды, в их молекулах все атомы углерода соединены одинарной связью. Состав предельных углеводородов – алканов может быть выражен общей формулой – СnH2n+2, где n – число атомов водорода. Таким образом, первый представитель алканов, у которого один атом углерода имеет формулу – CH4. Следующий алкан, у которого два атома водорода имеет формулу C2H6, третий – C3H8.
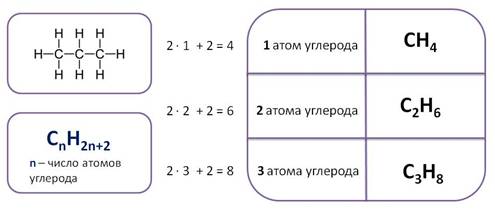
Таким образом, каждый последующий алкан отличается от предыдущего на группу CH2. Эта группа называется гомологической разностью, а ряд алканов – гомологическим рядом.
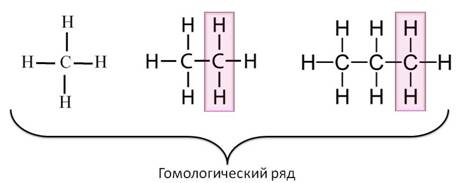
Гомологический ряд – ряд веществ, расположенных в порядке возрастания относительных молекулярных масс, сходных по строению и свойствам, но отличающихся друг от друга на одну или несколько групп CH2. Вещества такого ряда называют гомологами.
Цепь атомов углерода изображают в виде углеродного скелета, в котором указаны все атомы углерода и водорода, а во втором случае опускают символы атомов углерода и водорода, подразумевая, что стыки двух линий представляют атомы углерода с двумя атомами водорода.
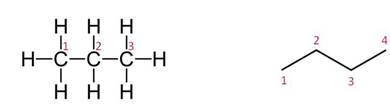
В молекулах алканов возможно свободное вращение групп атомов вокруг одинарных C–C связей.
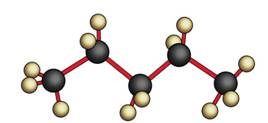
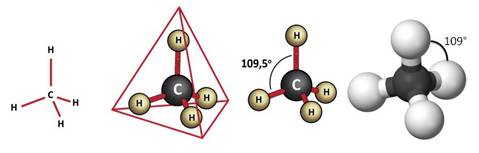
Так, молекула метана не является плоской, а в пространстве имеет тэтраэдрическое строение, то есть атом углерода находится в центре тэтраэдра, а атомы водорода – в вершинах тэтраэдра.
В молекуле метана все углерод-водородные связи являются равноценными, а углы между ними одинаковы и составляют приблизительно 1900.
В названии алканов используется суффикс – ан. Составим гомологический ряд алканов: CH4 – метан, C2H6 – этан, C3H8 – пропан, C4H10 – бутан, C5H12 – пентан, C6H14 – гексан, C7H16 – гептан, C8H18 – октан, C9H20 – нонан, C10H22– дэкан.
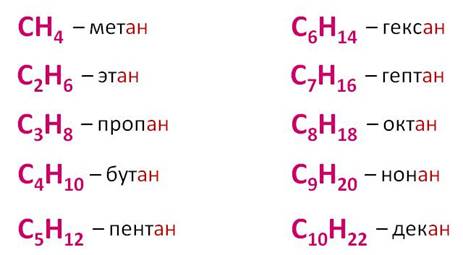
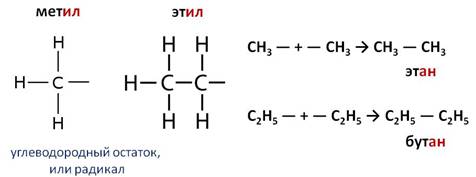
Если от метана отнять один атом водорода, то останется CH3 – углеводородный остаток, или радикал. Он называется метил – суффикс – ил. Если от этана отнять один атом водорода, то получится радикал C2H5 и он называется этил. Такие радикалы существуют очень короткое время. Они могут соединяться с другими радикалами или друг с другом. Если соединиться два метильных радикала, то образуется этан, если соединяться два этильных радикала, то образуется бутан.
Кроме углеводородов нормального строения есть ещё углеводороды разветвлённого строения. Допустим, вам нужно составить структурные формулы к бутану. Мы может в первом случае, расположить все атомы углерода по прямой линии, а во втором случае изобразить разветвлённое строение.
Эти вещества будут по отношению к друг другу изомерами. То есть, изомеры – вещества, которые имеют один и тот же количественный и качественный состав, но разное строение и свойства. А само явление существования изомеров называется изомерией.
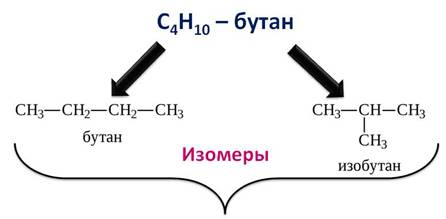
Посмотрите сами, первое соединение имеет состав C4H10 и второе такое же, но последовательность соединения атомов, то есть химическое строение их различно.
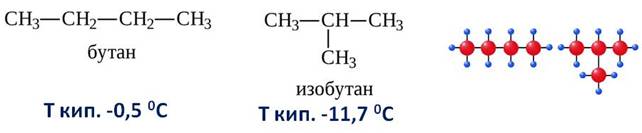
Первое соединение можно назвать нормальным бутаном, а второе изобутаном. Они отличаются строением и температурой кипения.
Рассмотрим таблицу.
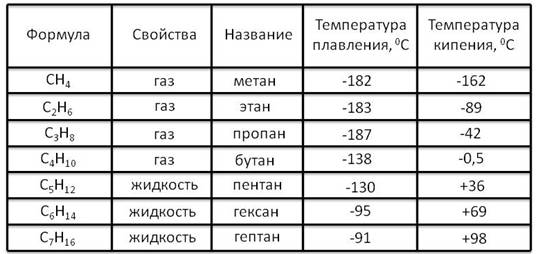
Из таблицы видно, что с увеличением числа атомов углерода увеличиваются температуры плавления и кипения. Первые четыре представителя алканов при обычных условиях – газы, начиная с пятого и заканчивая пятнадцатым атомом углерода – жидкости. Те алканы, у которых шестнадцать и больше атомов углерода – твёрдые вещества.
С1 ― С4 – газы; С5 ― С15 – жидкости; С16 и более – твёрдые вещества.
Алканы не имеют цвета, жидкие алканы обладают характерным запахом, а твёрдые не имеют запаха.
Кроме этого, алканы малорастворимы в воде.
Например, метан, при обычных условиях – газ, не имеющий запаха и цвета, он практически не растворяется в воде.
Алканы содержатся в нефти. Простейший их представитель – метан – образуется в результате разложения без доступа кислорода останков растительных и животных организмов. Этим объясняется выделение пузырьков газа со дна болот и водоёмов со стоячей водой, поэтому его называют болотным газом. Метан выделяется также из каменно-угольных пластов и накапливается в шахтах, поэтому его называют ещё и рудничным газом. Он является основной составной частью природного газа.
Твёрдые алканы входят в состав парафина. Наличие углерода и водорода в его составе можно легко доказать опытным путём. Кусочек парафиновой свечи подожжём лучинкой. На стенках стакана появляются капельки воды. Значит, в состав парафина входит водород. Вынем свечу и нальём в стакан известковой воды. Известковая вода помутнеет, из-за образования карбоната кальция, который образовался в реакции известковой воды с углекислым газом. Значит, в парафине есть и углерод.
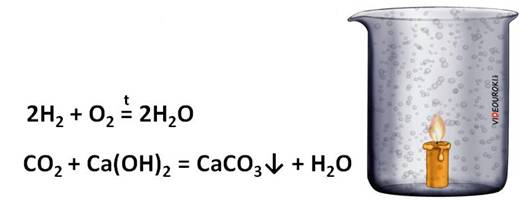
Алканы в химическом отношении малоактивны, потому что атомы углерода связаны друг с другом одинарными связями. Для алканов характерны реакции замещения, которые осуществляются за счёт разрыва C – H связи и замены атома водорода другим атомом.
Например, под действием света или при нагревании алканы реагируют с хлором и бромом. В реакции метана с хлором, на первой стадии образуется хлорметан и хлороводород. Как видите, один атом хлора заместил один атом водорода в молекуле метана и образовался хлороводород. На второй стадии опять один атом хлора замещает ещё один атом водорода и образуется дихлорметан и хлороводород, на третьей стадии ещё один атом хлора замещает атом водорода и образуется трихлорметан и хлороводород, наконец на последней стадии атом хлора замещает последний атом водорода и образуется тэтрахлорметан и хлороводород.
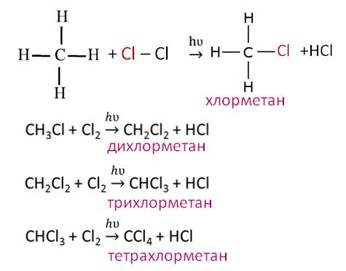
Таким образом, реакция шла до тех пор, пока все четыре атома водорода в молекуле метана не заместились полностью на атомы хлора. Этот процесс можно записать в виде одного уравнения, поставив перед молекулой хлора коэффициент 4.
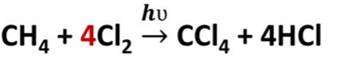
Обратите внимание, что вместо знака равенства в уравнениях реакций стоит стрелка, потому что двумя чёрточками в органической химии обозначается двойная связь.

Предельные углеводороды горят с образованием углекислого газа и воды. Например метан горит бесцветным пламенем с выделением большого количества теплоты.

Смесь метана с воздухом взрывоопасна. Такие смеси могут образоваться в шахтах, заводских котельных, в жилых помещениях.
При высоких температурах молекулы предельных углеводородов расщепляются. Например, метан при температуре 1500 0C распадается на углерод и водород.
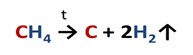
Ещё эта реакция называется реакцией дэгидрирования. То есть реакции, в результате которых от молекул органических соединений отщепляются молекулы водорода, называют реакциями дэгидрирования.
Алканы находят широкое применение. Метан используется, как природный газ, в качестве топлива, для синтэза аммиака, для получения метилового спирта, уксусной кислоты, синтетических каучуков, высококачественных сортов бензина, ацэтилена. Галогенпроизводные метана используются в качестве растворителей.
Таким образом, алканы – это углеводороды, содержащие в составе молекул только одинарные углерод-углеродные связи, их общая формула СnH2n+2, молекла метана имеет тэтраэдрическое строение. Для него характерны реакции замещения и окисления. Ряд углеводородов, соседние члены которого отличаются на группу CH2, называют гомологическим рядом, а члены ряда – гомологами. Гомологи имеют сходные химические свойства и закономерно изменяющиеся физические свойства.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 23417
23417


