Карбоновыми кислотами являются органические вещества, содержащие одну или несколько карбоксильных групп, а именно – СООН. Эта группа является функциональной для карбоновых кислот.
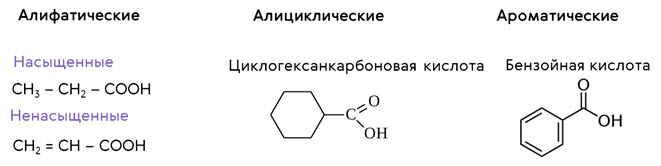
Есть несколько классификаций карбоновых кислот. По тому, какая связь лежит в основе строения, карбоновые кислоты бывают алифатические, или нециклические, алициклические, содержащие циклы, и ароматические, у которых есть ароматическое кольцо.
К насыщенным карбоновым кислотам относится, например, этановая кислота, у которой только σ-связи, а к ненасыщенным карбоновым кислотам относятся те кислоты, у которых есть кратные связи. Например, пропеновая кислота, которая содержит двойную связь.
К алициклическим карбоновым кислотам относятся кислоты, в молекулах которых есть цикл, например, циклогексанкарбоновая кислота. К ароматическим кислотам относятся кислоты, в молекулах которых есть ароматическое кольцо, например, бензойная кислота.
Если в составе кислоты одна функциональная группа, то это монокарбоновая кислота, или одноосновная, как, например, этановая кислота. Если в составе кислоты две функциональные группы, то это дикарбоновые, или двухосновные кислоты, например, щавелевая кислота является двухосновной.
Если в составе карбоновой кислоты содержится только одна карбоксильная группа, то у них общая формула CnH2n+1COOH, или R-COOH, где R – углеводородный радикал. Кроме этого, можно использовать ещё одну общую формулу, которая отражает молекулярный состав кислот, – это CnH2nO2.
Функциональная группа карбоновых кислот – СООН – называется карбоксильной, так как состоит из карбонильной группы и гидроксильной группы.
Строение карбоксильной группы определяет свойства карбоновых кислот. В этой группе электронная плотность смещена к атому с большей электроотрицательностью, то есть к атому кислорода, из-за этого на атоме углерода в этой группе возникает частичный положительный заряд, а у атома кислорода отрицательный. Причём в гидроксильной группе тоже происходит смещение электронной плотности к кислороду, и атом водорода при гидроксильной группе становится более подвижным. Связь между кислородом и водородом в гидроксильной группе становится более полярной, чем у спиртов, а соответственно, и атом водорода более подвижный, чем у спиртов.

Первым представителем ряда карбоновых кислот, у которого в составе один атом углерода и тот входит в состав карбоксильной группы, является метановая кислота, или её ещё называют муравьиная, кислоту, содержащую два атома углерода, называют этановая, или уксусная, третью – пропановая, или пропионовая, четвёртую – бутановая, или масляная кислота, пятую кислоту – пентановая, или валериановая, шестую – гексановая, или капроновая.

По правилам международной номенклатуры карбоновые кислоты называют таким образом: сначала название алкана, затем добавляют суффикса -овая- и слово «кислота». Отсчёт начинают от атома углерода, который входит в состав функциональной группы. Затем указывают положение заместителей в алфавитном порядке.
В первой кислоте пять атомов углерода в основной цепи, от второго атома углерода отходит заместитель этил, а от третьего – заместитель метил. Поэтому название кислоты будет 3-метил-2-этилпентановая кислота. У второй кислоты главная цепь состоит из пяти атомов углерода. От второго атома углерода отходит заместитель этил. Поэтому название этой кислоты будет 2-этилпентановая кислота.

У одноосновных карбоновых кислот различают изомерию углеродного скелета и межклассовую со сложными эфирами. Метановая, этановая и пропановая кислоты не имеют изомеров. У кислоты с молекулярной формулой цэ-четыре аш-восемь о-два есть такие изомеры, как бутановая кислота и два-метил-пропановая кислота. Межклассовыми изомерами будут метилпропаноат, этилэтаноат, пропилметаноат, изопропилметаноат.

Первый представитель ненасыщенных одноосновных карбоновых кислот – это пропеновая кислота (СН2 = СН – СООН), которая имеет ещё одно название – акриловая.
К высшим ненасыщенным одноосновным карбоновым кислотам относится олеиновая кислота – С17Н33СООН, у которой одна двойная связь находится между девятым и десятым атомами углерода.
К высшим ненасыщенным кислотам, которые содержат две и более кратные связи, относятся линолевая кислота – С17Н31СООН и линоленовая кислота – С17Н29СООН. В молекуле линолевой кислоты содержится две двойные связи, а в линоленовой кислоте три двойные связи.
Сорбиновая кислота также ненасыщенная одноосновная кислотой. В составе этой кислоты две двойные связи.

Среди высших насыщенных карбоновых кислот наиболее распространены пальмитиновая кислота – С15Н31СООН и стеариновая кислоты – С17Н35СООН. Их называют ещё высшими жирными кислотами, так как их природным источником являются жиры.
У карбоновых кислот с ростом количества атомов углерода в составе увеличиваются температуры кипения и плавления, а растворимость в воде, наоборот, уменьшается. Чем больше молярная масса карбоновой кислоты, тем больше её плотность. Метановая, этановая и пропановая кислоты – жидкости, имеют резкий запах, масляная и остальные кислоты, содержащие большое количество атомов углерода, являются жидкостями, они обладают неприятным запахом и плохо растворимы в воде.
Для карбоновых кислот характерны более высокие температуры кипения, чем для спиртов и альдегидов с тем же числом атомов углерода. Это объясняется тем, что образуются ассоциаты за счёт межмолекулярных водородных связей, то есть это межмолекулярное взаимодействие между кислотами. Причём у метановой и этановой кислоты прочность водородной связи такова, что даже в газообразном состоянии они существуют в виде димеров.
Например, муравьиная кислота – это летучая жидкость с резким неприятным запахом. При попадании на кожу вызывает ожоги. Смешивается с водой в любых соотношениях, то есть она неограниченно растворима в воде.
Уксусная
кислота – бесцветная жидкость. При охлаждении ниже 70  она
превращается в бесцветную кристаллическую массу, похожую на лёд, поэтому её
называют «ледяной» уксусной кислотой.
она
превращается в бесцветную кристаллическую массу, похожую на лёд, поэтому её
называют «ледяной» уксусной кислотой.
Уксусная эссенция – это 70-80 % водный раствор уксусной кислоты. А 3-9 % раствор уксусной кислоты называется столовым уксусом.
Высшие насыщенные карбоновые кислоты, у которых 10 и более атомов углерода, − твёрдые вещества, которые не имеют запаха и нерастворимы в воде.
Олеиновая кислота является ненасыщенной одноосновной карбоновой кислотой, представляет собой маслянистую жидкость, которая легче воды, без запаха, нерастворима в воде, но хорошо растворяется в органических растворителях, она входит в состав растительных жиров.
Химические свойства карбоновых кислот обусловлены их функциональной группой. Например, из-за подвижности атома водорода при гидроксильной группе растворимые в воде кислоты диссоциируют с образованием иона водорода. При диссоциации уксусной кислоты образуются ацетат-ион и ион водорода. Именно поэтому раствор уксусной кислоты изменяет окраску индикаторов. Лакмус изменяет окраску с фиолетовой на красную, метиловый оранжевый изменяет окраску с оранжевой на красную:
CH3COOH ↔ H+ + CH3COO-.
Кислотные свойства карбоновых кислот выражены сильнее, чем у спиртов, поэтому они реагируют с активными металлами, основаниями и солями (карбонатами). Например, в реакции цинка с уксусной кислотой образуется соль – ацетат цинка, или этаноат цинка:
2CH3COOH + Zn → (CH3COO)2Zn + H2↑.
Кислотные свойства карбоновых кислот проявляются в реакциях со щелочами, то есть в реакциях с сильными основаниями. Так, в реакции уксусной кислоты с гидроксидом натрия образуется ацетат натрия, или этаноат натрия. Спирты со щелочами не реагируют, в отличие от кислот карбоновых:
CH3COOH + NaOH → CH3COONa + H2O.
Карбоновые кислоты реагируют с основными оксидами. Так, в реакции уксусной кислоты с оксидом кальция образуется ацетат кальция, или этаноат кальция:
2CH3COOH + СaO → (CH3COO)2Ca + H2O.
Карбоновые кислоты реагируют с солями более слабых кислот. Например, в реакции уксусной кислоты с карбонатом натрия образуется ацетат натрия, или этаноат натрия, углекислый газ и вода:
CH3COOH + Na2CO3 → CH3COONa + H2O + CO2↑.
Карбоновые кислоты вступают в реакции со спиртами. Эти реакции называются ещё реакциями этерификации. В реакции уксусной кислоты с этанолом образуется сложный эфир – этиловый эфир уксусной кислоты, или этилэтаноат. Эти реакции обратимые, идут в кислой среде:
CH3COOH + C2H5OH ↔ CH3COOC2H5 + H2O.
Карбоновые кислоты могут вступать в реакции замещения атома водорода у альфа-углеродного атома на атом галогена в присутствии красного фосфора. Так, в реакции уксусной кислоты с хлором в присутствии красного фосфора образуется хлоруксусная кислота.

Ненасыщенные карбоновые кислоты вступают в реакции присоединения по двойным связям. Акриловая кислота реагирует с водородом, при этом образуется пропановая кислота. Акриловая кислота обесцвечивает бромную воду, при этом образуется 2, 3-дибромпропановая кислота.

Олеиновая кислота также является непредельной и вступает в реакции присоединения. Например, в реакции олеиновой кислоты с водородом образуется стеариновая кислота:
CH3 – (CH2)7 – CH = CH – (CH2)7 – COOH + Н2 → CH3 – (CH2)16 – COOH.
В реакции олеиновой кислоты с бромной водой образуется 9, 10-дибромоктадекановая кислота. При этом происходит обесцвечивание бромной воды:
CH3 – (CH2)7 – CH = CH – (CH2)7 – COOH + Br2 →
CH3 – (CH2)7 – СHBr – СHBr – (CH2)7 – COOH.
Наиболее распространённым способом получения карбоновых кислот является каталитическое окисление насыщенных углеводородов. Например, при каталитическом окислении бутана в присутствии солей марганца и кобальта образуется уксусная кислота.

В промышленности кислоты получают окислением соответствующих альдегидов. Так, при окислении пропанового альдегида образуется пропановая кислота.

Метановую кислоту в промышленности получают при взаимодействии оксида углерода (II) и горячего раствора гидроксида натрия при повышенном давлении. Сначала образуется соль муравьиной кислоты, которая под действием сильной кислоты превращается в муравьиную.

Высшие карбоновые кислоты в промышленности получают в результате гидролиза жиров.
В лаборатории карбоновые кислоты можно получить окислением первичных спиртов и альдегидов. Окислителями здесь могут выступать бихромат калия, перманганат калия.
Осуществим превращения: из бутана получим уксусную кислоту, затем из уксусной кислоты получим этилацетат, из этилацетата получим ацетат натрия, а из него – уксусную кислоту.

Решим задачу. Найдите массовую долю вещества в растворе, полученном растворением уксусного ангидрида массой 50 г в воде массой 100 г.


 Получите свидетельство
Получите свидетельство Вход
Вход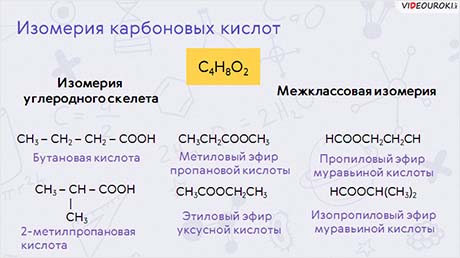




 2116
2116



