Карбонильными соединениями, или оксосоединениями, являются органические соединения, в которых есть карбонильная группа – С = О (оксогруппа).
К карбонильным соединениям относятся альдегиды и кетоны.
Альдегиды – это органические соединения, в которых карбонильная группа связана с атомами водорода или углеводородным заместителем. Поэтому общая формула альдегидов R – CHO, где R – алкильная группа. Функциональную группу у альдегидов называют альдегидной. Для альдегидов используют её общую формулу CnH2n+1CHO, для отражения молекулярного состава можно использовать и формулу CnH2nO.
Кетоны – это органические соединения, в которых карбонильная группа соединена с двумя радикалами. Поэтому общая формула кетонов R – CO – R`, где R, R` – алкильные группы.
В зависимости от природы углеводородного радикала альдегиды и кетоны могут быть предельными, непредельными или ароматическими. Непредельные альдегиды и кетоны содержат кратные связи в цепи. Ароматические альдегиды содержат альдегидную группу, связанную с ароматическим радикалом (например, бензойный альдегид – С6Н5 – СОН).
Ароматические кетоны содержат карбонильную группу, связанную с двумя радикалами, из которых один или оба являются ароматическими (например, дифенилкетон (С6Н5 – С (О) – С6Н5).
Рассмотрим строение карбонильной группы. Между атомом углерода и кислорода двойная связь. Атом углерода находится в состоянии sр2— гибридизации и образует три σ-связи, они расположены в одной плоскости под углом 1200, а π-связь между атомом углерода и кислорода образована при перекрывании 2р-орбиталей атомов углерода и кислорода. Атом кислорода при двойной связи оттягивает на себя электронную плотность, за счёт чего атом кислорода приобретает частичный отрицательный заряд, а атом кислорода – частичный положительный заряд. Связь С = O является полярной. Эта связь короче, чем – С = С –, но энергия С = О связи больше.

По правилам номенклатуры ИЮПАК названия альдегидов образуются от названий соответствующих алканов с добавлением суффикса -аль-. Например, НСНО – метаналь, СН3СНО – этаналь. При названии альдегидов с разветвлённой структурой нумерацию цепи начинают с атома углерода, который находится в составе альдегидной группы.
Назовём следующие альдегиды.

Первый альдегид называется 3,4-диметилпентаналь. Второй – 4-метил-3-этилгексаналь.
Для альдегидов характерны и тривиальные названия, так, альдегид НСНО называется формальдегид, или муравьиный альдегид, СН3СНО – уксусный альдегид, СН3СН2СНО – пропионовый альдегид.
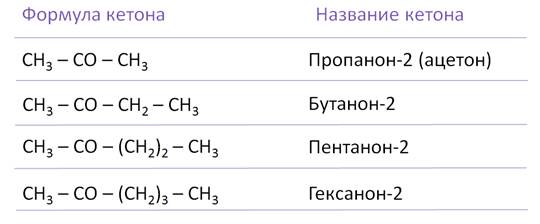
Кетоны часто называют по наименованию радикалов, связанных с карбонильной группой. По международной номенклатуре к названию углеводорода добавляют окончания «-он». Нумерацию начинают с конца цепи, где ближе карбонильная группа.
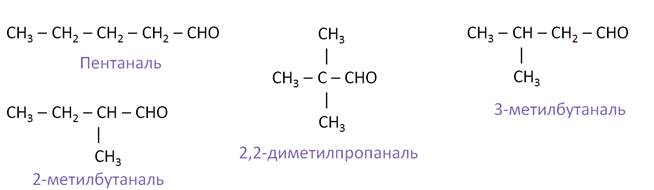
Изомерия альдегидов обусловлена изомерией углеродной цепи. Первые три представителя альдегидов изомеров не имеют. Составим всевозможные изомеры к альдегиду, состава С5Н10О. Первый альдегид – это пентаналь, второй – 2-метилбутаналь, третий – 3-метилбутаналь, четвёртый – 2, 2-диметилпропаналь.
Изомерия кетонов обусловлена изомерией
углеродной цепи и положением карбонильной группы в углеродной цепи.
Первые четыре представителя кетонов изомеров не имеют. Составим изомеры к
кетону состава С5Н10О. 
Рассмотрим физические свойства альдегидов. При обычных условиях метаналь находится в газообразном состоянии, имеет резкий неприятный запах и ядовит. Остальные альдегиды – жидкости и твёрдые вещества. Низшие альдегиды, как правило, имеют неприятный и резкий запах, высшие альдегиды обладают цветочным запахом.
Температуры кипения альдегидов ниже, чем у спиртов с таким же числом атомов углерода, так как в них отсутствуют межмолекулярные водородные связи.
Простейшие альдегиды хорошо растворяются в воде. Например, уксусный альдегид неограниченно растворим в воде, формальдегид достаточно хорошо растворим в воде.
Формалин – это 40 %-ный раствор формальдегида.
Химические свойства альдегидов и кетонов обусловлены строением карбонильной группы. Из-за того, что в карбонильной группе у атома кислорода частичный отрицательный заряд, а у атома углерода – частичный положительный, для альдегидов характерны реакции присоединения.
Для альдегидов и кетонов характерны реакции присоединения водорода. При этом образуются спирты. Так, в реакции этаналя с водородом в присутствии никелевого или платинового катализатора образуется этанол. Гидрирование альдегидов и кетонов относят к реакциям восстановления.

Кроме этого, альдегиды легко окисляются до соответствующих карбоновых кислот. Если к аммиачному раствору оксида серебра (I) прилить раствор уксусного альдегида и смесь нагреть, то образуется уксусная кислота и внутренняя поверхность пробирки покрывается тонким слоем серебра.
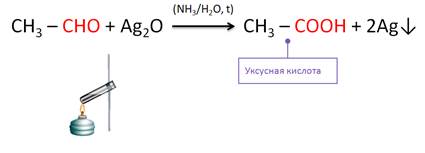
Эту реакцию называют реакцией «серебряного зеркала». Она является качественной для обнаружения альдегидов.
Ещё одной качественной реакцией на альдегиды является реакция со свежеприготовленным гидроксидом меди (II). Так, при окислении уксусного альдегида гидроксидом меди (II) образуется уксусная кислота и осадок красного цвета, представляющий собой оксид меди (I).

Окислить альдегиды можно также K2Cr2O7, KMnO4 или кислородом воздуха в присутствии катализатора. При этом также образуются карбоновые кислоты. Например, при окислении пропионового альдегида кислородом воздуха в присутствии катализатора образуется пропановая кислота.

В промышленных масштабах альдегиды получают из нефти, галогенпроизводных и спиртов.
В лаборатории альдегиды и кетоны получают окислением спиртов. Так, при окислении этанола оксидом меди (II) образуется уксусный альдегид.

При окислении пропанола-2 в тех же условиях образуется ацетон, который является кетоном.

Альдегиды и кетоны можно получить гидратацией алкинов. Так, гидратацией ацетилена в условиях реакции Кучерова образуется уксусный альдегид.

В результате присоединения воды к пропину образуется кетон – ацетон.

Одним из промышленных способов получения альдегидов является окисление алкенов в присутствии солей палладия.

Альдегиды можно получить и в реакции с алкенами – оксосинтез. Так, в реакции этилена с синтез-газом в определённых условиях образуется пропаналь.

Альдегиды и кетоны можно получить в реакции гидролиза дигалогензамещённых алканов. Например, в реакции 1,1-дихлорэтана с водным раствором щёлочи образуется этаналь, в реакции 2,2-дихлорпропана с водным раствором щёлочи образуется ацетон.

Альдегиды и кетоны получают дегидрированием спиртов в присутствии катализатора меди. Так, при дегидрировании первичного спирта этанола образуется этаналь, при дегидрировании вторичного спирта пропанола-2 образуется кетон – ацетон.


 Получите свидетельство
Получите свидетельство Вход
Вход




 1374
1374