Общее число электронов равно заряду ядра атома, числу протонов в нем и соответственно атомному номеру элемента.

Например, у водорода атомный номер один, значит заряд ядра атома тоже плюс один, а протонов и электронов по одному.

Распределение электронов происходит в зависимости от энергии по энергетическим уровням, письменное выражение которых называется электронной формулой или электронной конфигурацией атома.
Например, у лития, элемента с атомным номером три, электронная конфигурация один эс два два эс один.

В этой конфигурации цифрой слева записывается номер энергетического уровня, затем следует буква, обозначающая подуровень, и, наконец, цифра вверху справа указывает число электронов на этом подуровне.
Схематически электронное строение атома изображается с помощью электронно-графической схемы. Электронно-графическая схема атома лития:
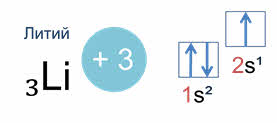
Орбитали обозначаются клеточками, а электроны стрелочками. На первом энергетическом уровне на эс орбитали находятся два спаренных электрона, а на втором уровне на эс орбитали только один неспаренный электрон.
По принципу минимальной энергии, электрон занимает тот энергетический уровень, тот подуровень или ту атомную орбиталь, которым соответствует минимальный запас энергии. Это значит, что вначале заполняются те уровни, подуровни и орбитали, которые находятся ближе к ядру.
Например, у атома азота вначале заполняется одна эс орбиталь первого энергетического уровня двумя электронами, а затем второго энергетического уровня два эс орбиталь – двумя электронами и два пэ орбиталь того же уровня – тремя электронами.
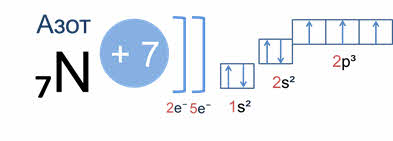
Орбитали в атомах элементов первых трех периодов заполняются электронами в порядке увеличения их энергии.
В атоме не может быть двух электронов, у которых все четыре квантовых числа охарактеризованы одинаковыми значениями, так гласит принцип австрийского ученого Вольфганга Эрнста Паули.

Хотя бы одним значением квантового числа электроны должны отличаться. Из этого принципа следует следствие: на каждой орбитали максимально может находиться не более двух электронов, причём с противоположными спинами.
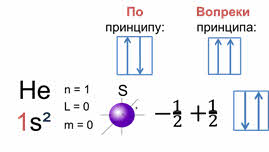
В качестве примера рассмотрим электронную формулу атома гелия – один эс два. Главное квантовое число, которого равняется одному, значит, побочное квантовое число будет равняться нулю, и соответственно всего один подуровень эс и одна орбиталь в форме сферы. Магнитное орбитальное квантовое число также равно нулю, так как оно равно сумме значений положительного отношения один к двум и отрицательного отношения один к двум. А эс подуровень атома гелия заполняется всего двумя электронами. Поскольку на первом электронном слое могут находиться максимально только два электрона, то этот слой в атоме гелия является завершённым и, следовательно, очень устойчив.

У атомов элементов второго периода начинает заполняться второй энергетический уровень, на котором может находиться максимально восемь электронов.
Так у атомов лития и бериллия электронами заполняется только два эс орбиталь.
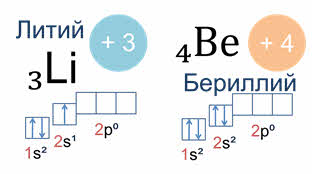
А у атома бора пятый электрон уже занимает одну из трёх два пэ орбиталей. Вот так выглядят электронная и электронно-графическая формулы атома бора.
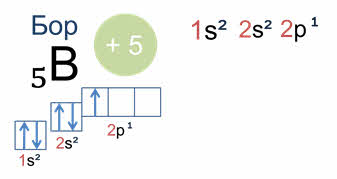
Подуровень два пэ изображён вплотную к подуровню два эс, но несколько выше. Тем самым подчёркивается его принадлежность к одному и тому же уровню и одновременно больший запас энергии.
По правилу немецкого учёного Генриха Хунда в пределах определённого подуровня электроны располагаются таким образом, чтобы суммарный спин был максимальным.

Электроны сначала заполняют все пустые орбитали одного подуровня по одному, а если число электронов больше, чем число орбиталей, то по два. Однако в атоме имеются атомные орбитали с одинаковым запасом энергии, но расположенные на различных энергетических уровнях.
В таком случае применяем правило русского ученого Всеволода Маврикиевича Клечковского: энергия электронов в атоме определяется суммой значений главного и побочного квантовых чисел, поэтому, сначала заполняются электронами те энергетические уровни и подуровни, для которых сумма значений главного и побочных квантовых чисел минимальна.
Рассмотрим первый элемент четвертого периода – калий.
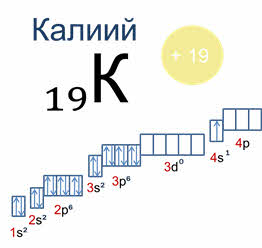
У него появляется четвёртый электронный слой, открывающийся эс подуровнем. Однако в третьем периоде был только завершен подуровень пэ у аргона.
Возникает вопрос: вначале будет заполняться три дэ или четыре эс подуровень? На три дэ подуровне сумма главного и побочного чисел равна пяти. А сумма главного и квантового чисел четыре эс подуровня равна четырем. Приходим к выводу, что четыре меньше пяти.
Значит энергия подуровня четыре эс несколько меньше, чем подуровня три дэ.

Заполняется первым четыре пэ подуровень или три дэ подуровень, если значения сумм главного и побочного квантовых чисел на двух подуровнях равны пяти? Вспомним принцип минимальной энергии: энергия на три дэ подуровне меньше, чем на четыре пэ, следовательно, вначале будет заполняться три дэ подуровень.

Поэтому в этом случае только после того как заполнился четыре эс подуровень, начинает заполняться электронами дэ подуровень третьего, теперь уже предвнешнего, энергетического уровня.
В атоме каждый электрон располагается так, чтобы его энергия была минимальной, что отвечает наибольшей связи его с ядром. А энергетические уровни и подуровни выражаются общей формулой распределения, но необходимо не забывать при заполнении все правила и принципы электронной конфигурации атомов.
Рассмотрим, как происходит заполнение электронами атомов элементов второго и третьего периодов.
У элементов второго периода согласно принципу минимальной энергии, вначале заполнится первый энергетический уровень, а затем будет заполняться по принципу Паули, правилу Хунда – второй энергетический уровень.
На втором энергетическом уровне максимально может находиться только восемь электронов, поэтому электронный слой атома неона является завершенным и очень устойчивым.

В атомах элементов третьего периода начинает формироваться третий электронный слой. Сначала заполняется электронами эс подуровень у натрия и магния, а затем пэ подуровень у алюминия, кремния, хлора и аргона. В атоме аргона на внешнем электронном слое находится восемь электронов.
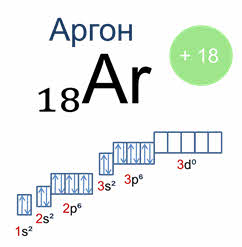
Следовательно, он завершён, так как в атоме любого элемента на внешнем энергетическом уровне максимально может находиться не более восьми электронов. Застраивание третьего электронного слоя этим не исчерпывается. В соответствии с формулой число электронов на уровне равно произведению два на эн в квадрате максимально на нём может находиться 18 электронов: восемь на эс и пэ-подуровнях и десять на дэ подуровне.

В зависимости от того, на какой атомной орбитали находится последний электрон, химические элементы можно разделить на следующие семейства: эс, пэ, дэ, эф.
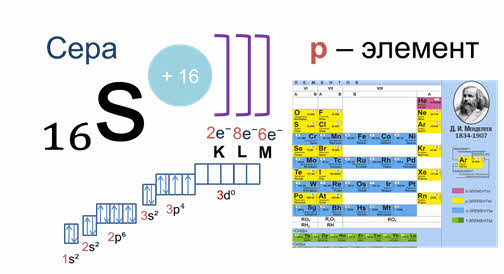
Принадлежность химического элемента к тому или иному электронному семейству можно определить по электронной конфигурации, которая показывает расположение электронов на энергетических уровнях и орбиталях атомов. Записать такую формулу можно с помощью периодической системы Дмитрия Ивановича Менделеева. Для элементов малых периодов, состоящих только из главных подгрупп, это совсем не сложно. Например, сера, элемент номер 16 расположенный в третьем периоде, главной подгруппе шестой группы. Следовательно, ядро ее атома имеет заряд плюс 16, на электронной оболочке, которой располагается 16 электронов. На первом уровне 2 электрона на один эс орбитали, на втором уровне два электрона на два эс орбитали и 6 электронов на два пэ орбитали. На третьем уровне два электрона на три эс орбитали, четыре электрона на три пэ орбитали. Значит сера — это элемент, относящийся к пэ семейству, потому что последний ее электрон располагается на три пэ орбитали.
Для элементов побочных подгрупп следует учитывать тот факт, что у атомов этих элементов строится не внешний уровень. На нем, как правило, будут находиться не два эс электрона, а дэ орбитали предвнешнего уровня. На них может поместиться не более десяти электронов.
Например, строение электронной оболочки элемента номер 22 титана, который расположен в четвертом периоде побочной подгруппы IV группы Периодической системы Дмитрия Ивановича Менделеева.

Следовательно, ядро его атома имеет заряд плюс 22 и на электронной оболочке находятся 22 электрона: на первом уровне два электрона на один эс орбитали, на втором уровне восемь электронов, на два эс орбитали два электрона и шесть электронов на два пэ орбитали. На внешнем, четвертом – два эс электрона как у элемента побочной подгруппы, и остальные 10 электронов – на третьем уровне (два на три эс орбитали, шесть на три пэ орбиталях и оставшиеся два на три дэ орбиталях). Значит титан это дэ элемент, так как последний электрон в его атоме располагается на незавершенной – три дэ орбитали.
Распределение электронов в атоме по энергетическим уровням, подуровням и орбиталям отображают с помощью электронных конфигураций и электронно-графических схем. Для правильного заполнения атомных орбиталей электронами необходимо применять принцип минимальной энергии, принцип Паули, правило Хунда и правило Клечковского.

 Получите свидетельство
Получите свидетельство Вход
Вход



 1
1 9771
9771


Хорошая разработка на пять