Ядерная физика изучает строение ядра атома и изменения, происходящие с ним.
Раздел физики квантовая механика характеризует микрочастицы (протоны, нейтроны, электроны) и построенные из них атомные ядра, атомы и молекулы, как объекты с двойственной природой, то есть рассматривает их как частицы и волны.

Электрон не просто перемещается в атоме, а движется с огромной скоростью, может располагаться в любые точки возле ядра атома, но вероятность его пребывания в разных точках неодинакова. В одних местах вероятность пребывания его больше, а в других меньше.

Электрон, двигаясь в атоме, образует электронное облако, то есть объем пространства относительно ядра. Электронная плотность облака
оказывается разной в различных точках атома. По мере удаления от ядра она
увеличивается, а затем снижается. Это своеобразная квантовомеханическая модель, с помощью которой описывается состояние электрона в атоме. Объем пространства относительно ядра, в котором сосредоточено около 90% электронной плотности, называется атомной орбиталью. Чем больше энергия электрона, тем слабее он притягивается к ядру, тем больше по размерам его электронное облако. Электронная плотность с увеличением размера орбитали уменьшается.
Квантовая ячейка или клеточка – это графическое изображение орбитали. Иногда атомная орбиталь может изображаться пунктиром. Например, вот так выглядит орбиталь атома водорода.

Также у электрона есть собственный момент движения по часовой и против часовой стрелки вокруг своей оси, который называется спином, так как от английского слова «спин» значит вращение. На одной орбитали находятся только два электрона, у которых спины направлены в противоположных или антипараллельных направлениях. Это выглядит следующим образом.
В этом случае два электрона называются спаренными. Потому что им такое состояние энергетически более выгодно, чем состояние с параллельными спинами. Соответственно, находящийся на орбитали один электрон является неспаренным.
По форме выделяют следующие виды орбитали:
· Сферическую или шарообразную орбиталь, которая обозначается буквой эс (s-орбитали).
· Электроны, находящиеся на ней, называются S-электронами.

· Гантелеобразные или в форме «восьмёрки» орбитали, которые взаимно перпендикулярны, подобно осям координат x (икс), y (игрик) и z (зэт). Они обозначаются буквой пэ (p), а электроны, находящиеся на них, называются пэ-электронами.

· Четыре орбитали дэ-типа (d-орбитали) имеют объёмную форму четырёхлистников, которые называют «клеверным листом», отличающиеся между собой лишь положением в пространстве. Пятая дэ-орбиталь представляет собой объемную восьмерку, продетую в кольцо. Эти орбитали характерны для переходных элементов, начиная со скандия. Электроны, расположенные на этих орбиталях, соответственно, называются дэ-электронами.

· У орбиталей эф-типа (f-орбитали) ещё более сложное строение, электроны, находящиеся на этих орбиталях называются эф-электронами. Заполнение такими электронами орбиталей происходит в атомах химических элементов семейств лантаноидов и актиноидов.
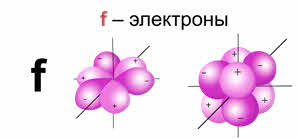
Энергия орбитали зависит от расстояния ядра до максимальной электронной плотности, которое называется атомным радиусом. Чем больше радиус орбитали, тем больше энергия.
Электроны с близкими значениями энергии составляют в атоме единый электронный слой (или энергетический уровень).
Номер периода в Периодической системе химических элементов Д.И. Менделеева соответствует количеству энергетических уровней в атоме.
Например, элементы третьего периода в атоме имеют три энергетических уровня, а четвёртого – четыре энергетических уровня.


Электроны внутри своего уровня могут отличаться между собой энергией связи с ядром атома. Так на энергетическом уровне возникают подуровни.

Количество подуровней на энергетическом уровне равняется номеру энергетического уровня. Например, номер энергетического подуровня четыре, следовательно, происходит открытие четырёх подуровней. Все сложные движения электрона в атоме характеризуется энергетическими числами, которые называют квантовыми числами. Главное квантовое число обозначается английской буквой эн (n), оно определяет общую энергию электрона энергетического уровня и принимает значения целых чисел. 1, 2, 3, …, и так до бесконечности.

В атомах химических элементов первый уровень составляет одна эс орбиталь, на ней находятся два электрона. Второй энергетический уровень содержит также эс орбиталь, но большего размера, так как запас энергии выше. На втором уровне также содержатся три пэ орбитали, на них располагается максимально шесть электронов. Третий энергетический уровень, кроме три эс и три пэ, содержит три дэ подуровень с пятью атомными орбиталями. На четвёртом уровне появляются орбитали эф-типа, которых максимально может быть только семь.

Приходим к выводу, что число орбиталей на данном уровне равно квадрату номера уровня. На каждой орбитали могут располагаться только два электрона, значит максимальное число электронов на уровне равно удвоенному квадрату номера уровня.

Подуровни энергетического уровня характеризуются побочным квантовым числом эл. Побочное квантовое число зависит от главного квантового числа и принимает значения от нуля до эн минус один. Побочное квантовое число характеризует форму атомной орбитали и уточняет её энергию по формуле сумма главного и побочного чисел равно энергии атомной орбитали.

Если побочное квантовое число равно нулю, то открывается подуровень эс с эс-орбиталью, если побочное квантовое число равно единице, то открывается подуровень пэ с пэ-орбиталями, если эл равно двум, то открывается подуровень дэ с дэ орбиталями. При эл равным трём открывается подуровень эф с эф орбиталями.

Количество орбиталей на подуровне определяется магнитным квантовым числом – эм. Магнитное квантовое число определяет распределение орбиталей в магнитном поле ядра, оно определяется с помощью побочного квантового числа и принимает значения от нуля до разности эл минус один.

Магнитное квантовое число равно сумме два эл плюс один. Например, при эл равным нулю, магнитное квантовое число равно нулю, а орбиталь тоже одна. При эл равным один, магнитное квантовое число равно минус один, ноль, плюс один, три орбитали.

Все орбитали располагаются симметрично в пространстве, а спиновое квантовое число эс независимо, оно является квантовым свойством электрона.
Момент импульса электрона или спин не связан с движением в пространстве. Для всех электронов абсолютное значение спина один к двум.


Проекция спина на ось – это магнитное спиновое число, которое может иметь лишь два значения: плюс один к двум или минус один к двум, потому что спин электрона величина постоянная.
Рассмотрим периодическую систему химических элементов, с помощью которой определим количество энергетических уровней, подуровней, вычислим число орбиталей в уровне и подуровне, а также рассчитаем максимальное число на энергетическом уровне и подуровне.
Например, в третьем периоде главное квантовое число равно трём, значит на третьем энергетическом уровне три подуровня: три эс, три пэ, три дэ. Число орбиталей в уровне по формуле равно девяти.

В подуровне три эс – одна орбиталь, подуровне три пэ – три орбитали, подуровне три дэ – пять орбиталей. Максимальное число электронов в уровне рассчитываем по формуле произведение два на эн в квадрате, получаем восемнадцать электронов.

Значит, на подуровне эс находятся два электрона, на подуровне пэ – шесть электронов, на подуровне дэ – десять электронов. Приходим к выводу. Квантовые числа электрона описывают энергию, количество орбиталей, их форму и расположение в пространстве.

 Получите свидетельство
Получите свидетельство Вход
Вход




 7068
7068

