В античные времена считалось, что атомы – это неделимые частицы. Еще древний философ Демокрит утверждал, всё окружающее нас состоит из неделимых частиц или атомов.

Благодаря важнейшим открытиям физиков конца XIX – начала XX века было доказано обратное. Так в 1895 году Вильге́льм Ко́нрад Рентге́н — немецкий физик, работавший в Вюрцбургском университете, открыл электромагнитное излучение с различными длинами волн. Их так и называют рентгеновские лучи в честь фамилии выдающегося учёного.

В 1897 году английский ученый Джозеф Джон Томсон при Кембриджском университете доказывает, что все частицы, которые образуют катодные лучи сходны и из них состоят вещества, и открывает электрон.

Годом ранее французский физик Антуан Анри Беккерель, исследуя соли урана, открывает явление радиоактивности.

Его работу по изучению явления радиоактивности продолжают дальше физики-химики Пьер Кюри и Мария Склодовская-Кюри. Это открытие принесло им вместе с Анри Беккерелем в 1903 году Нобелевскую премию.

Следующим этапом в развитии атомного учения была модель атома «Пудинг с изюмом» Джона Томсона в 1904 году. В кругообразном заряженном положительно пудинге утопают, словно изюминки, электроны, которые заряжены отрицательно. Электроны совершают колебательные движения, благодаря которым атом испускает электромагнитную энергию, а сам атом – электронейтрален. Но эта гипотеза не получила научного подтверждения.

Эрнест Резерфорд в 1907 году разрабатывает ядерный или планетарный вид атома. По центру располагается положительно заряженное ядро, вокруг него движутся электроны, которые заряжены отрицательно. Но, почему атом испускает и поглощает энергию, это теория не объясняла.
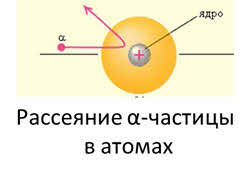
В 1913 году датский физик – Нильс Бор разработал квантовый вид строения атома, выдвинув следующие постулаты. Электроны передвигаются по замкнутым орбитам в соответствии значения своей энергии, которая не выделяется и не поглощается при этом. Электрон может переходить из одного в другое разрешенное энергетическое состояние, испуская или поглощая при этом энергию.

Эта теория носила противоречивый характер, так как рассматривала атом как частицу, движущуюся по строго определенным траекториям и с определенной скоростью.
В 1932 году независимо друг от друга русский физик Дмитрий Дмитриевич Иваненко и немецкий физик-теоретик Ве́рнер Карл Ге́йзенберг выдвинули протонно - нейтронную теорию, что ядра атомов — это положительно заряженные протоны и нейтрально заряженные нейтроны.
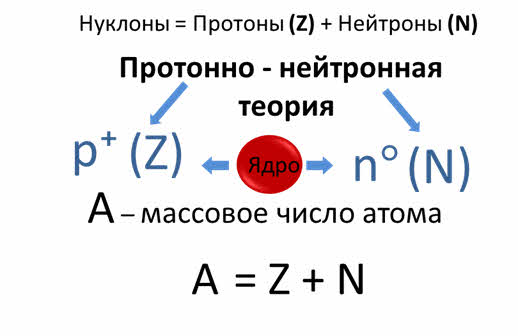
Эти частицы называют нуклонами. Было доказано, что масса атома сосредоточена именно в ядре. Сумма чисел протонов и нейтронов — это массовое число атомов. Теория тем самым объяснила существование разновидности атомов химических элементов, которые имели одинаковый атомный номер, но разные массовые числа, то есть изотопов. Из всего выше сказанного, следует, что атом – электронейтральная система, состоящая из положительно заряженного ядра и отрицательных электронов. Порядковый номер элемента в Периодической системе равен заряду ядра, числу протонов и электронов.
Число нейтронов определяется как разница числа протонов от массового числа атома.
Пример.
Состав ядра фосфора: заряд ядра фосфора плюс пятнадцать.

Соответственно, протонов и электронов у него по пятнадцать. Массовое число равно тридцати одному.

Найдём число нейтронов как разницу числа протонов от массового числа.

Тогда число нейтронов в ядре атома фосфора равно шестнадцати. Изменение числа протонов в атоме приводит к образованию нового химического элемента, потому что изменяется заряд ядра атома.

Что же произойдет, если в атоме уменьшить число нейтронов. Ответ прост. Изменение числа нейтронов в атоме приводит к изменению атомной массы элемента. Таким образом, образуется изотоп.

Свойства изотопов одного и того же элемента одинаковы, так как имеют одинаковый заряд ядра, хотя относительная атомная масса разная, так они содержат разное число нейтронов; изменение атомной массы элементов незначительное – оно имеет долевое значение.
Например, у водорода три изотопа, у каждого из которых есть свое название.
Это протий, дейтерий и тритий.

Так протий имеет заряд плюс один и массу атома один, а нейтронов в ядре вообще нет.
Дейтерий имеет заряд атома плюс один и массу атома два, нейтронов всего один. Тритий имеет заряд атома плюс один, массу атома три, нейтронов содержится два. Итак, изотопы водорода отличаются по своим свойствам, так как они имеют изменение массы весьма существенное – в кратное значение раз.
Значит химический элемент – это совокупность атомов с одинаковым зарядом ядра, то есть с одинаковым числом протонов в нем.
В Периодической системе Дмитрия Ивановича Менделеева под знаком химического элемента записывают среднее значение относительной атомной массы всех его природных изотопов.
Известны следующие способы существования химических элементов: свободные атомы, простые вещества, сложные вещества.



Свободные атомы содержат одинаковое число протонов в атомном ядре, в форме нуклидов одного и того же элемента. Например, изотопы водорода.

Простые вещества содержат один и тот же химический элемент, могут встречаться в аллотропных модификациях. Например, у атома кислорода это простое вещество кислород о два и простое вещество озон о три, которые состоят из одного химического элемента, но из разного числа его атомов.

Сложные вещества могут иметь одинаковый качественный и количественный состав, но отличаться строением. Например, межклассовые изомеры в органических соединениях этанол и диметиловый эфир.


 Получите свидетельство
Получите свидетельство Вход
Вход




 8334
8334

