Рассмотрим физические свойства карбоновых кислот. В целом, в ряду гомологов с увеличением молекулярной массы уменьшается растворимость кислот в воде и плотность, а температуры кипения возрастают. Первые три члена гомологического ряда – жидкости, которые имеют резкий запах, начиная с масляной кислоты, идут кислоты, которые являются жидкостями, они обладают неприятным запахом и плохо растворимы в воде.
Для карбоновых кислот характерны более высокие температуры кипения, чем для спиртов и альдегидов с чем же числом атомов углерода. Это объясняется образованием ассоциатов за счёт межмолекулярных водородных связей. Причём у метановой и этановой кислоты прочность водородной связи такова, что даже в газообразном состоянии они существуют в виде димеров.

Например, муравьиная кислота представляет собой летучую жидкость с резким неприятным запахом. При попадании на кожу вызывает ожоги. Смешивается с водой в любых соотношениях.
В старину раздражающее действие муравьиной кислоты использовали для лечения ревматизма и подагры. В настоящее время её также применяют для растирания при ревматизме в виде 1 %-го спиртового раствора, который называют муравьиным спиртом. Раньше для его получения муравьёв настаивали на спирту.
Уксусная кислота известна издавна. Впервые концентрированную уксусную кислоту путём перегонки винного и древесного уксуса в 1537 году получил Парацельс. Парацельс – немецкий естествоиспытатель, врач, философ, один из основателей ятрохимии. Считается одним из основателей современной науки.

Уксусная кислота – бесцветная жидкость. При охлаждении ниже 17 0C она превращается в бесцветную кристаллическую массу, похожую на лёд, поэтому её называют «ледяной» уксусной кислотой.
Уксусная эссенция – это 70-80 % водный раствор уксусной кислоты. А 3-9 % раствор уксусной кислоты называется столовым уксусом.
Высшие кислоты, у которых 10 и более атомов углерода, − твёрдые вещества, которые не имеют запаха и нерастворимы в воде.
В 1825 году французские учёные М. Э. Шеврель и Ж. Л. Гей-Люссак получили патент на производство стеариновых свечей. Эти свечи экономичнее восковых, давали яркое пламя и образовывали меньше копоти.
Олеиновая кислота является ненасыщенной одноосновной карбоновой кислотой, представляет собой маслянистую жидкость, которая легче воды, без запаха, нерастворима в воде, но хорошо растворяется в органических растворителях.
Химические свойства карбоновых кислот обусловлены карбоксильной группой. Как и любые кислоты, карбоновые кислоты способны отщеплять атом водорода в виде протона. Так, растворимые в воде кислоты диссоциируют обратимо с образованием иона водорода. При диссоциации уксусной кислоты образуется ацетат-ион и ион водорода. Именно поэтому, раствор уксусной кислоты изменяет окраску индикаторов. Лакмус изменяет окраску с фиолетовой на красную, метиловый оранжевый изменяет окраску с оранжевой на красную.

Кислотные свойства карбоновых кислот проявляются в реакциях с активными металлами. Например, в реакции магния с уксусной кислотой образуется соль – ацетат магния, или этаноат магния.
2CH3COOH + Mg → (CH3COO)2Mg + H2↑
Кислотные свойства карбоновых кислот проявляются в реакциях нейтрализации, то есть в реакциях с сильными основаниями. Так, в реакции уксусной кислоты с гидроксидом калия образуется ацетат калия, или этаноат калия.
CH3COOH + KOH → CH3COOK + H2O
Карбоновые кислоты реагируют с основными оксидами. Так, в реакции уксусной кислоты с оксидом магния образуется ацетат магния, или этаноат магния.
2CH3COOH + MgO → (CH3COO)2Mg + H2O
Карбоновые кислоты реагируют с солями более слабых кислот. Например, в реакции уксусной кислоты с гидрокарбонатом натрия образуется ацетат натрия, или этаноат натрия, углекислый газ и вода.
CH3COOH + NaHCO3 → CH3COONa + CO2↑ + H2O
Карбоновые кислоты вступают в реакции со спиртами – это реакции этерификации. В реакции уксусной кислоты с метанолом образуется сложный эфир – метиловый эфир уксусной кислоты, или метилэтаноат.
CH3COOH + CH3OH ↔ CH3COOCH3 + H2O
Карбоновые кислоты могут вступать в реакции замещения атома водорода у α-углеродного атома на атом галогена в присутствии красного фосфора. Так, в реакции уксусной кислоты с хлором в присутствии красного фосфора образуется хлоруксусная кислота.
CH3COOH + Cl2 ↔ CH2(Cl)COOH + HCl
Ненасыщенные карбоновые кислоты вступают в реакции присоединения по кратным связям. Акриловая кислота реагирует водородом, при этом образуется пропановая кислота. Акриловая кислота обесцвечивает бромную воду, при этом образуется 2,3-дибромпропановая кислота.

Кроме этого, акриловая кислота может вступать в реакцию полимеризации с образованием полимера.

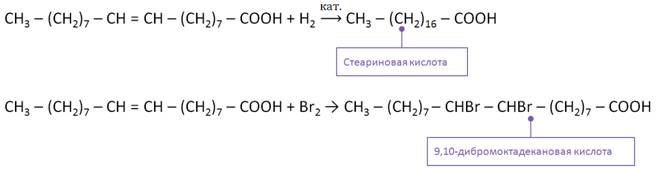
Олеиновая кислота также является непредельной и вступает в реакции присоединения. Например, в реакции олеиновой кислоты с водородом образуется стеариновая кислота. Эта реакция имеет большое значение, так как лежит в основе производства маргарина.
В реакции олеиновой кислоты с бромной водой образуется 9,10-дибромоктадекановая кислота. При этом происходит обесцвечивание бромной воды.
Наиболее распространённым способом получения карбоновых кислот является каталитическое окисление насыщенных углеводородом. Например, при каталитическом окислении бутана образуется уксусная кислота.

В промышленности кислоты получают окислением соответствующих альдегидов. Так, при окислении уксусного альдегида образуется уксусная кислота.

Метановую кислоту в промышленности получают при взаимодействии оксида углерода (II) и горячего раствора гидроксида натрия при повышенном давлении. Сначала образуется соль муравьиной кислоты, которая под действием сильной кислоты превращается в муравьиную.
CO + NaOH → HCOONa
HCOONa + H2SO4 → HCOOH + NaHSO4
Высшие карбоновые кислоты в промышленности получают в результате гидролиза жиров.
В лаборатории карбоновые кислоты можно получить окислением первичных спиртов и альдегидов. Окислителями здесь могут выступать K2Cr2O7, KMnO4.

Таким образом, химические свойства карбоновых кислот обусловлены наличием карбоксильной группы. Кислотные свойства карбоновых кислот связаны со способностью атома водорода отщепляться в виде протона. Кислотные свойства карбоновых кислот проявляются в реакциях с металлами, основными оксидами, основаниями и солями слабых кислот. Ненасыщенные кислоты сочетают свойства и карбоновых кислот, и алкенов. Источниками получения карбоновых кислот являются насыщенные углеводороды и их производные.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 7787
7787



