На основании закона сохранения массы веществ составляют уравнения химических реакций. Химическое уравнение – условная запись химической реакции с помощью химических формул и знаков.
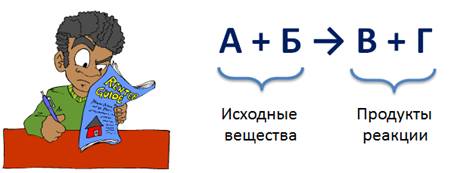
В левой части уравнения записывают формулы или формулу веществ, которые вступили в химическую реакцию. Их называют исходными веществами, между ними знак «плюс», в правой части уравнения записывают формулы или формулу продуктов реакции, т.е. веществ, которые образуются в результате реакции, между ними тоже ставят знак «плюс», а между левой и правой частью уравнения ставят стрелку.
Химическую реакцию можно изобразить молекулярным уравнением. Т.е. молекулярное уравнение – это уравнение, в котором исходные вещества и продукты реакции записаны в виде молекул. Если в результате реакции образуется осадок, то возле него справа ставят стрелку, направленную вниз (↓), а если выделяется газ, то возле него справа ставят стрелку, направленную вверх (↑).
После записи схемы уравнения находят коэффициенты, т.е. цифры, стоящие перед формулами веществ, чтобы число атомов до и после реакции было одинаковым.
Например, запишем уравнение реакции водорода с кислородом. Вначале укажем формулы веществ, вступивших в химическую реакцию – это водород (Н2) и кислород (О2), между ними ставим знак «плюс», в результате реакции образуется вода – Н2О. Между веществами левой и правой части ставим стрелку. Посмотрим, сколько атомов водорода в левой и правой части. Получается два атома водорода до и после реакции, а кислорода до реакции 2 атома, после реакции – один атом. Поэтому в правой части уравнения перед формулой воды ставим коэффициент 2. Но теперь в правой части уравнения стало 4 атома водорода, а в левой только 2. Чтобы уровнять число атомов водорода, необходимо в левой части уравнения перед водородом поставить коэффициент 2. Т.к. мы уровняли число всех атомов в левой и правой части уравнения, то теперь ставим не стрелку, а знак равенства.

Для правильного подбора коэффициентов в уравнении реакции следует выполнять некоторые условия:
· Перед формулой простого вещества можно записывать дробный коэффициент. Например, в реакции горения бутана:
С4Н10 + О2 → СО2 + Н2О. Перед формулой СО2 ставим коэффициент 4, т.к. в реакцию вступает 4 атома углерода, перед формулой воды ставим коэффициент 5, т.к. в реакцию вступает 10 атомов водорода. В результате реакции образуется 13 атомов кислорода, а до реакции 2 атома, значит перед формулой кислорода необходимо поставить коэффициент 6,5. А так как, коэффициент показывает не только число атомов, но и молекул, то следует удвоить коэффициент в уравнении. Получается, уравнение будет иметь вид: 2С4Н10 + 13О2 → 8СО2 + 10Н2О.
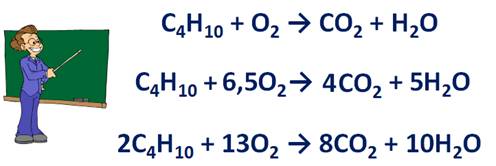
· Если в схеме реакции есть соль, то сначала уравнивают число ионов, образующих соль. Например, в результате реакции фосфорной кислоты и гидроксида кальция образуется соль – фосфат кальция и вода.
Н3РО4 + Са(ОН)2 → Са3(РО4)2 + Н2О. Эта соль состоит из фосфат-ионов с зарядом 3- и ионов кальция с зарядом 2+. Уравняем их число, записав перед формулой фосфорной кислоты коэффициент 2, а перед формулой гидроксида кальция – коэффициент 3.
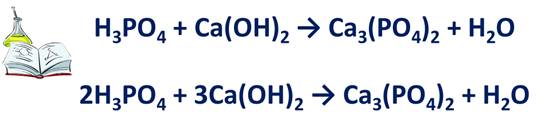
· Если в схеме реакции есть атомы водорода и кислорода, то сначала уравниваются атомы водорода, а только потом кислорода. Из предыдущей схемы видно, что в левой части уравнения 12 атомов водорода, в правой – только 2, значит, перед формулой воды необходимо поставить коэффициент 6. Подсчитаем число атомов кислорода. До реакции их 14, после реакции тоже 14. Поэтому можно вместо стрелки поставить знак равенства.
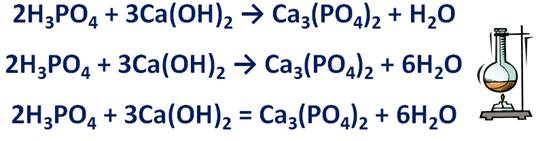
· Если в схеме реакции имеется несколько формул солей, то начинать уравнивание следует с ионов, входящих в состав соли, содержащей большее их число. Например, в реакции нитрата бария и сульфата алюминия образуется две соли – сульфат бария и нитрат алюминия. Наибольшее число ионов содержит соль – нитрат алюминия, поэтому сначала нужно уравнять ионы, которыми образована эта соль, т.е. ионы алюминия и нитрат-ионы. Ba(NO3)2 + Al2(SO4)3 → BaSO4 + Al(NO3)3. У алюминия заряд 3+, у нитрат-ионов – 1-. Поэтому в левой части уравнения перед формулой Ba(NO3)2 ставим коэффициент 3. Перед формулой Al2(SO4)3 нужно поставить коэффициент 1, но он не ставится. Уравниваем остальные ионы. Ионов бария до реакции 3, после реакции 1, поэтому перед формулой BaSO4 ставим коэффициент 3, нитрат-ионов до реакции 6, поэтому в правой части уравнения перед Al(NO3)3 ставим коэффициент 2. Число атомов алюминия до и после реакции одинаково, т.е. 2. Ионов бария и сульфат-ионов до реакции и после реакции одинаково – по 3.
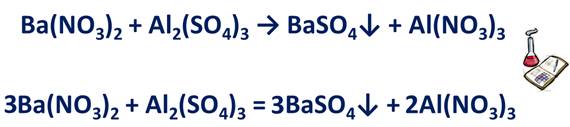
· Если число атомов какого-то элемента в одной части схемы уравнения четное, а в другой нечетное, то необходимо перед формулой с нечетным числом атомов поставить коэффициент 2, а затем уровнять число всех атомов. Например, расставим коэффициенты в реакции алюминия с кислородом. Al + O2 → Al2O3. В результате реакции образуется оксид алюминия – Al2O3. Число атомов кислорода до реакции четное, т.е. равно двум, а после реакции нечетное – 3. Поэтому перед формулой оксида алюминия ставим коэффициент 2. В результате у нас стало 6 атомов кислорода после реакции, значит, в левой части уравнения перед формулой кислорода ставим коэффициент 3. Начинаем уравнивать число атомов алюминия до и после реакции. До реакции 1 атом, после реакции – 4. Следовательно, в левой части уравнения перед формулой алюминия ставим коэффициент 4. Теперь число атомов каждого химического элемента в левой и правой части схемы уравнения одинаково, и стрелку следует заменить знаком равенства.


 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 38157
38157