Химические явления, или химические реакции, отличаются от физических тем, что в результате химических реакций происходит превращение одних веществ в другие. Причем, образовавшиеся вещества отличаются от исходных по своим свойствам. Например, железный гвоздь на воздухе ржавеет, ржавчина – это уже не железо, а совсем другое вещество, отличающееся по свойствам от железа. С химическими явлениями мы встречаемся и в повседневной жизни: скисание молока, гниение листьев, фотосинтез.

Признаки химических реакций: выпадение осадка, выделение газа, появление запаха, выделение или поглощение теплоты, появление света, изменение цвета.

Проследим за протеканием химических реакций и установим признаки, которые подтверждают образование новых веществ и появление у них новых свойств.
Например, при растворении никеля в соляной кислоте, образуется раствор соли изумрудно-зеленого цвета. Образование новых веществ говорит о том, что прошла химическая реакция, признак ее – изменение цвета.

Добавив в раствор сульфида натрия соляной кислоты, появляется запах тухлых яиц. Это запах сероводорода. Признак этой реакции – появление запаха, а образование сероводорода говорит о том, что это химическое явление.
Если к бесцветному раствору йодида калия добавить бесцветный раствор нитрата свинца (II), то образуется две новые соли и выпадает осадок желтого цвета.

Химическое явление можно наблюдать, если кусочек мела бросить в раствор соляной кислоты. При этом наблюдается бурное выделение углекислого газа.
А железный гвоздь, опущенный в раствор соляной кислоты, покрывается пузырьками, эти пузырьки – водород.

Если мы к раствору медного купороса добавим щелочь, то у нас образуется осадок голубого цвета. Прилив к этому осадку раствор кислоты, он раствориться. Эти признаки свидетельствуют о том, что прошла химическая реакция.

Смешаем порошки серы и железа, но новые вещества не образуются, а просто будет смесь веществ, которую можно разделить на компоненты с помощью магнита, или смешав с водой. Под действием магнита, железные опилки притягиваются к нему, а сера нет. При растворении в воде сера всплывает вверх, а железные опилки опустятся вниз. Но если исходную смесь нагреть, то происходит между ними химическая реакция, которая сопровождается выделением большого количества теплоты и образуется новое вещество – FeS – сульфид железа (II). Оно серого цвета, тонет в воде и не притягивается магнитом. Поэтому это явление, горение железных опилок и серы, является химическим.

Если же в ложечке сжечь серу, но она загорится синим пламенем, при этом выделяется теплота и свет, появляется запах жженой серы, эти признаки тоже свидетельствуют о том, что процесс горения серы относится к химическим явлениям.
Реакция горения магния идет очень быстро, он горит ослепительным пламенем с образованием нового вещества – оксида магния. Фосфор тоже сгорает в кислороде с образованием оксида фосфора (V).

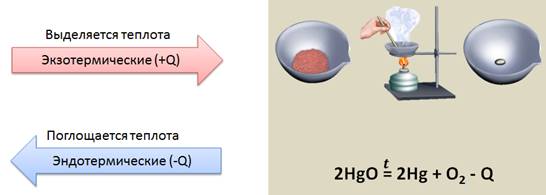
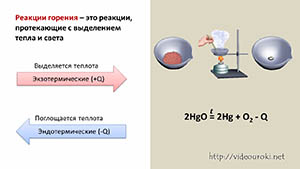
Реакции, которые протекают с выделение теплоты и света, называются реакциями горения.
Кроме того, реакции, протекающие с выделением теплоты, называются экзотермическими (экзо – наружу), а реакции, протекающие с поглощением теплоты, называются эндотермическими (эндо – внутрь). К эндотермическим реакциям относится реакция разложения оксида ртути (II). Оксид ртути (II) представляет собой вещество красного цвета. При нагревании образуется кислород, который улетучивается и ртуть – металл серебристо-белого цвета.
Чтобы химическая реакция прошла, необходимы определенные условия:
· Необходимо, чтобы реагирующие вещества соприкоснулись, чем больше будет площадь их соприкосновения, тем быстрее пойдет реакция, для этого твердые вещества измельчают и перемешивают, а растворимые – растворяют и сливают растворы;
· Нагревание – второе условие, которое в основном необходимо для эндотермических реакций, для экзотермических оно необходимо для начала реакции, а в некоторых случаях и вовсе не нужно;
· Некоторые реакции не протекают без света, электрического тока. Например, для процесса фотосинтеза – свет – это необходимое условие.
В 1748 г. М.В. Ломоносов открыл закон сохранения массы веществ, который гласит: масса веществ, вступивших в химическую реакцию, равна массе веществ, получившихся в результате ее.
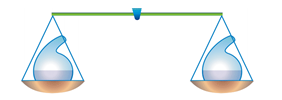
Носителями массы веществ являются атомы химических элементов, из которых состоят как вещества, которые вступают в химическую реакцию (реагенты), так и вещества, образовавшиеся в результате реакции (продукты реакции). При химических реакциях атомы не разрушаются и не образуются, а происходит только их перегруппировка.
Для подтверждения своего закона Ломоносов провел следующий опыт: в специальный сосуд налил соляную кислоту и щелочь – гидроксид натрия. К раствору щелочи налил несколько капель фенолфталеина и раствор щелочи окрасился в малиновый цвет. Закрыл сосуд пробкой, взвесил, а затем слил растворы. При этом окраска малиновая исчезла, т.к. прошла химическая реакция, а масса продуктов реакции оказалась такой же, как и исходная.
Подтверждение закона сохранения массы веществ

Мы можем сами доказать справедливость этого закона. Уравновесим на весах колбу с раствором хлорида железа (III), в которую опущена пробирка с гидроксидом натрия. Взвесим колбу. Смешаем растворы, у нас появляется осадок бурого цвета – гидроксид железа (III). Появление осадка говорит о том, что прошла химическая реакция. Взвесим колбу снова и видим, что масса не изменилась.
Закон сохранения массы веществ является основным законом химии. На основании этого закона составляют уравнения химических реакций и проводят расчеты по уравнениям.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 9155
9155

