Данная тема посвящена посвятим тому, что вспомним некоторые важные определения, понятия и формулы, относящиеся к квантовой механике, а также дадим общие рекомендации по решению задач на данную тему.
И так, как же возникло учение о квантах? Из курса электродинамики известно, что теоретические исследования Джеймса Клерка Максвелла показали, что свет есть электромагнитные волны определенного диапазона, что позже подтвердил Генрих Герц в своих опытах. Электромагнитная теория смогла объяснить многие наблюдаемые явления, в том числе, давление, интерференцию и дифракцию света. Но такое явление, как дисперсия, теория Максвелла объяснить не смогла. Это было сделано голландским ученым Хендриком Лоренцем, создавшим электронную теорию взаимодействия света с веществом.
Но и дополненная теория Максвелла нуждалась в уточнениях. Ведь такие явления, как, например, распределение мощности излучения в спектре абсолютно черного тела или возникновение линейчатых спектров и законы фотоэффекта, она объяснить не могла.
Нова теория была выдвинута в одна тысяча девятисотом году Максом Планком. Согласно его гипотезе, электроны атомов излучают свет не непрерывно, а отдельными порциями — квантами. При этом энергия кванта пропорциональна частоте колебаний электрона в веществе.
Квантовые представления о свете, введенные в науку Планком, развил далее Альберт Эйнштейн. Он пришел к выводу о том, что свет не только излучается, но и распространяется в пространстве, и поглощается веществом в виде квантов.
Вот таким вот образом и возникло учение о квантах и, собственно, квантовая физика, которая смогла объяснить ряд явлений, наблюдаемых при взаимодействии света с веществом.
В 1887 году Генрих Герц открыл явление внешнего фотоэффекта, которое было изучено русским ученым Александром Григорьевичем Столетовым.
Внешний фотоэффект возникает при взаимодействии вещества с поглощаемым электромагнитным излучением, при этом происходит вырывание электронов с поверхности вещества.
Проводя свои эксперименты, Столетов установил следующий закономерности фотоэффекта:
1) При отсутствии напряжения между электродами фототок отличен от нуля, что можно объяснить наличием у фотоэлектронов при вылете кинетической энергии.

2) При некотором значении напряжения между электродами сила фототока перестает зависеть от напряжения, то есть достигает насыщения.

3) Если поменять местами полярности катода и анода, то в электростатическом поле между электродами фотоэлектроны будут тормозится и, при некотором значении этого отрицательного напряжения, фототок полностью прекратится.
На основании этих экспериментальных данных были сформулированы законы фотоэффекта.
Первый закон фотоэффекта звучит следующим образом: сила фототока насыщения пропорциональна общему числу фотоэлектронов, покидающих поверхность металла за единицу времени.
Второй закон формулируется так: при увеличении частоты падающего света максимальная кинетическая энергия линейно возрастает. При этом кинетическая энергия не зависит от интенсивности падающего света.

Третий закон говорит о том, что красная граница фотоэффекта зависит только от рода вещества катода. Напомним, что красная граница — это минимальная частота (или максимальная длина волны), при которой еще возможен фотоэффект.



А четвертый закон утверждает, что фотоэффект практически безинерционен, так как с момента облучения металла светом, до вылета электрона проходит время порядка миллиардной доли секунды.
В 1905 году для объяснения экспериментальных законов фотоэффекта Эйнштейн использовал квантовые представления о свете, введенные Планком, и применил их к поглощению света веществом.
И так фотон, обладающей энергией hν, падая на поверхность металла, поглощается электроном поверхностного слоя металла. И если энергия фотона равна или превышает работу выхода, то электрон вылетает из металла. При этом часть энергии фотона тратится на совершение работы выхода, а остальная часть переходит в кинетическую энергию фотоэлектрона.

Таким образом, было установлено, что свету присущи и корпускулярные свойства. В настоящее время принято считать, что свет обладает двойственной корпускулярно-волновой природой. Двойственность свойств света находит свое выражение в формулах, которые вы сейчас видите на экране. В них корпускулярные характеристики фотона (энергия, масса и импульс) связаны с волновой характеристикой — частотой.
В 1927 году Нильс Бор сформулировал принцип дополнительности. Звучит он следующим образом: для полного понимания природы света необходимо учитывать, как волновые, так и корпускулярные свойства света: они взаимно дополняют друг друга. Однако следует помнить, что для объяснения какого-либо эксперимента следует использовать либо волновые, либо корпускулярные представления о природе света, но не те и другие одновременно.

Теперь немного поговорим о физике атома и атомного ядра.
Bзвестно, что атомы представляют собой очень прочные системы, несоизмеримо более устойчивые, чем составленные из атомов молекулы. Поэтому до конца 19 века атомы считались простейшими неделимыми частицами вещества. Однако последующее развитие науки опровергло эту точку зрения. Было установлено, что атомы представляют собой достаточно сложные образования. Одним из таких фактов стали опыты Резерфорда по рассеиванию альфа-частиц.
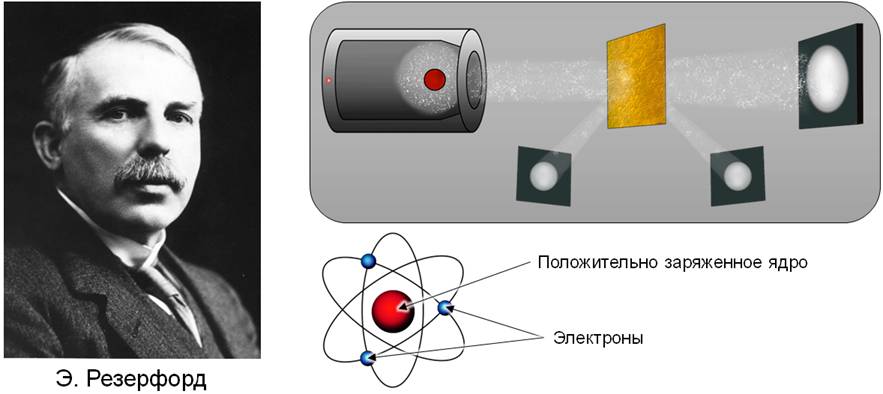
На основании проделанных опытов Резерфорд предложил ядерную (или планетарную) модель атома. Согласно модели, в центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома. А вокруг неподвижного ядра по замкнутым орбитам вращаются электроны, число которых совпадает с порядковым номером элемента в таблице Менделеева.
Однако некоторое время и эта модель считалась не состоятельной, так как согласно расчетам, в этой модели атом должен быть неустойчивым. Противоречия возникли из-за того, что к электронам в атомах применяли законы классической физики, а в микромире действуют свои законы.
Первым, кто признал невозможность применения классических законов физики к атомам, был датский ученый Нильс Бор, который в 1913 году ввел элементы квантовой теории в модель атома Резерфорда и создал неклассическую теорию атома. В основе этой теории лежит три постулата.
Первый постулат (его еще называют постулатом стационарных состояний), говорит о том, что существуют особые, стационарные состояния атома, находясь в которых, атом не излучает энергию, при этом, электроны в атоме движутся с ускорением.

Второй постулат Бора еще называют правилом частот. Согласно ему, атом, при переходе из одного стационарного состояния в другое, излучает или поглощает квант энергии.

В третьем постулате (правило квантования орбит) говорится о том, что в стационарном состоянии атома электрон, движущийся по круговой орбите, должен иметь квантованные (дискретные) значения момента импульса.

Исходя из этих постулатов и используя планетарную модель строения атома, Бор разработал количественную теорию атома водорода. Данная модель была крупным шагом в развитии атомной физики и явилась важным этапом в создании квантовой механики. С ее помощью удалось объяснить основные закономерности в спектрах атомов водорода и водородоподобных систем и вычислить частоты спектральных линий.
Оставалось, однако, неясным, от чего зависит интенсивность излучений тех или иных частот. Остался без ответа и вопрос, почему совершаются те или иные переходы. И, самое главное, с помощью модели атома Бора невозможно было описать атом гелия — один из простейших атомов, непосредственно следующий за водородом.
Поэтому в 1925 — 1927 годах на смену модели атома Бора пришла квантовая механика, которая явилась строгой непротиворечивой теорией и имела свой собственный математический аппарат.
Сведём в таблицу основные формулы на световые кванты, действие света.
|
Формула |
Описание формулы |
|
|
Энергия фотона, где h = 6,63 ∙ 10−34 Дж ∙ с — постоянная Планка, v — частота, c = 3 ∙ 108 м/с — скорость света в вакууме, λ — длина волны. |
|
|
Импульс фотона. |
|
|
Уравнение Эйнштейна для внешнего фотоэффекта, где Авых — работа выхода электрона, m — масса электрона, υmax — максимальная скорость фотоэлектрона. |
|
|
Максимальная кинетическая энергия фотоэлектрона, где е — заряд электрона, Uз — задерживающее напряжение. |
|
|
Красная граница фотоэффекта. |
|
|
Световое давление, где I — интенсивность света, ρ — коэффициент отражения света. |
Теперь сведём в таблицу основные формулы физики атома.
|
Формула |
Описание формулы |
|
|
Энергия электрона, находящегося на стационарной орбите в атоме водорода, где е — заряд электрона, ε0 — электрическая постоянная, r — радиус боровской орбиты электрона. |
|
|
Энергия, излученная или поглощенная атомом водорода, где W1 и W2 — энергии атома в соответствующих стационарных состояниях. |
|
|
Обобщенная формула Бальмера, где R — постоянная Ридберга, n — номер орбиты, на которую переходит электрон, k — номер орбиты, с которой переходит электрон. |
|
|
Условие квантования стационарных орбит, где m — масса электрона, υn —скорость электрона на n-ой орбите, rn — радиус n-ой орбиты. |
|
|
Радиус n-ой стационарной орбиты электрона в атоме водорода. |
Сведём в таблицу основные формулы для элементов квантовой механики.
|
Формулы |
Описание формулы |
|
|
Формула де Бройля, где λБ — длина волны де Бройля, h — постоянная Планка, m — масса частицы, υ — скорость частицы. |
|
|
Соотношение неопределенностей Гейзенберга, где Δх — неопределенность координаты, Δрх — неопределенность проекции импульса, ћ = h/2π. |
|
|
Соотношение неопределенностей, где ΔW — неопределенность значения энергии системы, Δt — неопределенность промежутка времени пребывания системы в данном состоянии |
Методические рекомендации по решению задач по квантовой физике.
1) Необходимо всегда помнить о взаимосвязи между волновыми и квантовыми характеристиками частиц.
2) Помните, что взаимодействие фотонов с веществом подчиняется законам сохранения импульса и энергии (законы фотоэффекта следуют из закона сохранения энергии, а формула для расчета светового давления является следствием из закона сохранения импульса).
3) Следует помнить и основные положения ядерной модели атома с точки зрения классической электродинамики для расчета характеристик движения электрона в атоме.
4) Необходимо учитывать то, что, согласно положениям квантовой физики, радиус орбиты электрона, энергия атома, энергия излученного или поглощенного кванта могут иметь только определенные дискретные значения.

 Получите свидетельство
Получите свидетельство Вход
Вход


















 0
0 2035
2035

