Изучая физику и химию в младших классах, вы узнали о том, что все вещества имеют дискретное строение, то есть они состоят из очень-очень маленьких частичек — атомов, молекул и ионов. Атомы и молекулы, взаимодействуя друг с другом, образуют разнообразные вещества. И если число частиц не велико (до нескольких десятков или сотен), то говорят о микросистеме. Однако мы с вами живём в макромире, состоящем из макроскопических тел (так принято называть тела, состоящие из огромного числа частиц). Краб и песчинка, море и маяк, Луна и человек — всё это примеры макроскопических тел.

В механике мы с вами изучали движения макроскопических тел под действием приложенных сил. Но происхождение этих сил не выясняли. Например, мы знаем, что при сжатии или растяжении тела в нём появляются силы упругости. Но почему они возникли? А почему возникают силы трения и силы сопротивления среды? Наконец, механика просто не в состоянии объяснить, почему существуют агрегатные состояния вещества. Ответы на эти и другие вопросы даёт нам молекулярно-кинетическая теория строения вещества (сокращённо МКТ), основы которой заложил Даниил Бернулли в 1738 году. А началом её становления послужила корпускулярно-кинетическая теория тепла, выдвинутая в середине XVIII века Михаилом Васильевичем Ломоносовым.
В основе современной молекулярно-кинетической теории лежат три важных и самых главных положения. Во-первых, все, абсолютно все вещества́ состоят из мельчайших частиц, разделённых между собой промежутками.

Этими частицами являются молекулы, атомы и ионы. Молекулой называется мельчайшая частица вещества, сохраняющая его химические, но не сохраняющая физические свойства.
Молекулы состоят из ещё более мелких частиц — атомов. Атом — это мельчайшая частица химического элемента, сохраняющая его химические свойства.
В свою очередь, и атомы представляют собой достаточно сложные образования. Но в классической молекулярно-кинетической теории мы их будем считать твёрдыми неделимыми частичками сферической формы.
Второе положение МКТ говорит нам о том, что все частицы вещества находятся в непрерывном хаотическом движении.
А в третьем утверждается, что частицы в веществе связаны друг с другом силами молекулярного взаимодействия, которые в зависимости от расстояния являются силами притяжения или отталкивания.

Первое положение МКТ косвенно подтверждается явлениями сжимаемости и растворимости веществ. А также законом сохранения массы, сформулированным выдающимся русским учёным Михаилом Васильевичем Ломоносовым в 1755 году, законом простых объёмных отношений реагирующих газов, который в 1808 году открыл француз Жозеф-Луи Гей-Люссак, и законом кратных отношений, сформулированным в 1803 году английским учителем-самоучкой Джоном Дальтоном. Кстати, последний закон можно объяснить только на основе представлений о дискретном строении вещества.
Но самое главное доказательство существования мельчайших частиц и, в частности, атомов, было получено после изобретения в 1981 году сканирующего туннельного микроскопа. С его помощью были получены первые фотографии атомов вещества.
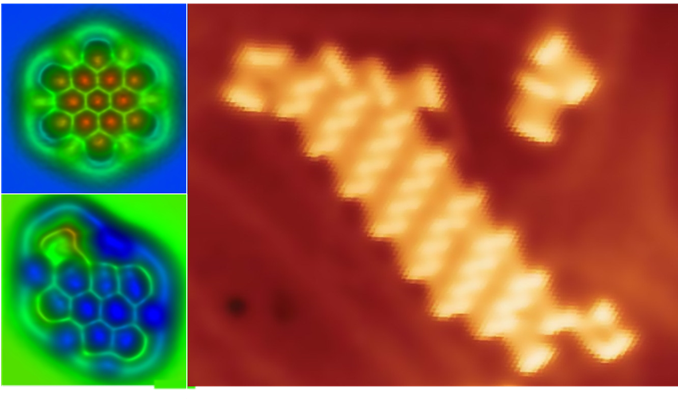
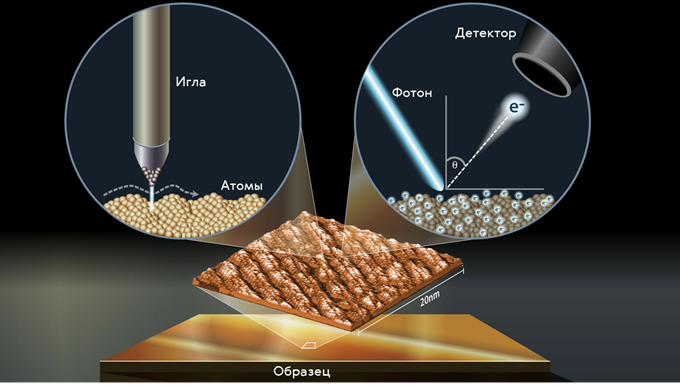
Принцип работы такого микроскопа достаточно простой. Очень острая игла (на её кончике буквально один атом) подводится к образцу на расстояние порядка 0,1 нм. При подаче на иглу относительно образца очень малого напряжения возникает туннельный ток (о нём мы с вами будем говорить позднее), величина которого зависит от расстояния образец — игла. Игла может, например, двигаться на фиксированной высоте над образцом. Прибор фиксирует изменение величины туннельного тока, и таким образом идёт построение топографии поверхности.
Второе и третье положения МКТ можно подтвердить таким явлением, как диффузия. Напомним, что диффузией называется самопроизвольное взаимное проникновение молекул соприкасающихся веществ.
Диффузия проявляется во всех телах. Например, в жидкостях её можно пронаблюдать на таком опыте. Аккуратно нальём в стакан с раствором медного купороса слой воды и оставим его в комнате с постоянной температурой. Через некоторое время мы заметим, как исчезнет резкая граница между слоями этих двух жидкостей. А через несколько дней они полностью перемешаются.

Как вы понимаете, массы различных атомов и молекул очень и очень малы. Следовательно, определить массу одной молекулы или атома путём обычного взвешивания просто невозможно. Поэтому при расчётах обычно используют не абсолютные, а относительные значения масс, получаемые путём сравнения масс атомов и молекул с атомной единицей массы. По международному соглашению за одну атомную массу принимается 1/12 массы атома чистого изотопа углерода 12С:
1 а. е. м. = 1,66 ∙ 10–27 кг.
В этом случае масса атома любого химического элемента выражается числом, очень близким к целому. Это число называется относительной молекулярной (или атомной) массой вещества. Оно равно отношению массы атома (или молекулы) данного вещества к атомной единице массы:

Относительные атомные массы всех химических элементов представлены в таблице Менделеева рядом с номером элемента.
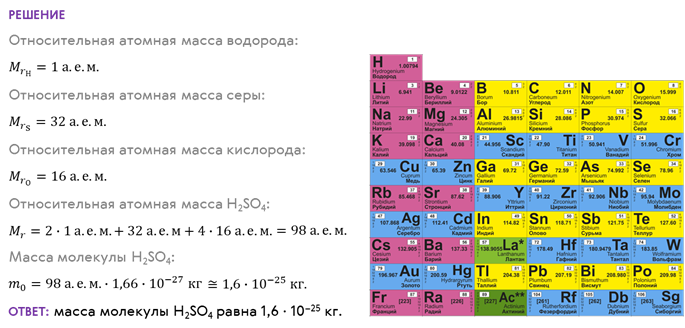
Таким образом, зная химическую формулу вещества, можно приближённо посчитать его относительную молекулярную массу. Например, давайте с вами определим массу одной молекулы серной кислоты, химическая формула которой Н2SО4.
Для характеристики количества вещества в любом макроскопическом теле можно было бы использовать число молекул или атомов в нём. Но это число просто огромно. Например, в теле человека содержится ~7 ∙ 1027 атомов различных химических элементов. Поэтому в расчётах используется не абсолютное их число, а относительное. В СИ единицей количества вещества является моль.
Один моль — это количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой двенадцать грамм.
Давайте с вами посчитаем, сколько же частиц содержится в одном моле чистого изотопа 12С. Для этого разделим массу углерода, взятого в количестве одного моля, на массу одного атома углерода, выраженную в килограммах:
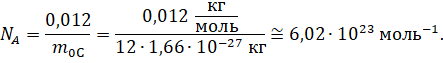
Именно столько частиц содержится в одном моле любого вещества. А полученное нами значение называется числом (или постоянной) Авога́дро, названной так в честь итальянского химика Амедео Авогадро, который первым предположил, что при одинаковых температуре и давлении в равных объёмах идеальных газов содержится одинаковое число молекул.
Зная значение постоянной Авогадро, можно определить количество вещества (то есть число молей в данной порции вещества) как отношение числа молекул в веществе к числу Авогадро:
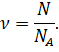
Тело, обладающее количеством вещества в один моль, имеет привычные для нас макроскопические размеры и массу.
Наряду с относительной молекулярной массой в физике и химии широко используется понятие молярной массы. Так принято называть массу вещества, взятого в количестве одного моля:
M = m0NA.
В записанном уравнении т0 — это масса одной молекулы. Из формулы следует, что единицей измерения молярной массы в СИ является кг/моль.
Молярная и относительная молекулярная масса связаны между собой простым соотношением. Чтобы его найти, давайте сначала выразим из формулы относительной молекулярной массы массу одной молекулы вещества.
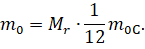
А затем подставим это выражение и выражение для числа Авогадро в формулу для молярной массы:
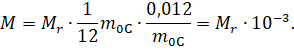
Очевидно, что если мы будем знать массу одной молекулы какого-либо вещества и число молекул в теле, то масса этого тела будет равна произведению массы одной молекулы на число молекул в теле:
m = m0N.
Теперь давайте выразим из этой формулы число молекул:
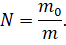
А из определения молярной массы — число Авогадро:
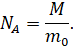
И подставим эти выражения в формулу для количества вещества.
После небольших преобразований получим, что количество вещества равно отношению массы вещества к его молярной массе. Именно такое определение количества вещества известно вам из курса химии.
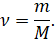
И нам осталось оценить размеры молекул. Для этого воспользуемся самым простым, хотя и не самым точным методом и определим диаметр молекулы воды, если плотность воды равна 1000 кг/м3.


 Получите свидетельство
Получите свидетельство Вход
Вход





 13292
13292

