Фенолы – это производные ароматических углеводородов, в молекулах которых один или несколько атомов водород, непосредственно связанных с бензольным кольцом, замещены на гидроксильные группы.
Число гидроксильных групп определяет атомность фенола. Первый представитель этого класса называется фенол – С6Н5ОН. От его названия и происходит название класса – фенолы. Группу С6Н5– называют фенильной группой.
Рассмотрим электронное строение молекулы фенола. Одна неподелённая пара электронов от атома кислорода вступает в сопряжение с π-электронной системой бензольного кольца. Происходит смещение электронной плотности в сторону бензольного кольца, это приводит к усилению С – О связи и ослаблению О – Н связи.
Сопряжение неподелённой пары электронов атома кислорода с π-электронной системой приводит также к перераспределению электронной плотности. Эта электронная плотность понижается на атоме углерода, который связан с гидроксильной группой, но повышается у атомов углерода в положениях два, четыре, шесть. Поэтому гидроксильная группа и бензольное кольцо взаимно влияют друг на друга.

Фенол представляет собой бесцветное кристаллическое вещество с резким характерным запахом. Фенол незначительно растворим в воде при обычной температуре, но хорошо растворяется в горячей воде. Фенол ядовит, при попадании на кожу вызывает сильнейшие ожоги.
Химические свойства фенола будут обусловлены взаимным влиянием гидроксильной группы и бензольного кольца.
Фенол проявляет кислотные свойства, поэтому в водных растворах он диссоциирует по типу кислоты с образованием протона водорода, поэтому фенол называют карболовой кислотой.

Фенол, как и спирты, взаимодействует со щелочными металлами. Так, в реакции фенола с натрием образуется фенолят натрия и водород.

Фенол реагирует с растворами щелочей, так как кислотные свойства у него выражены сильнее, чем у спиртов. Например, в реакции фенола с гидроксидом натрия образуется фенолят натрия и вода.
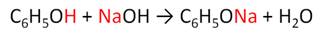
Кислотные свойства у фенола выражены слабее, чем у неорганических кислот, даже таких, как угольная кислота. Поэтому, если добавить к водному раствору фенолята натрия соляную кислоту, то образуется фенол и хлорид натрия.
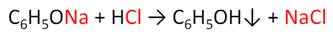
Реакции галогенирования у фенола протекают с замещением атомов водорода в бензольном кольце. Так, в реакции фенола с бромной водой образуется белый осадок 2, 4, 6-трибромфенола. Эта реакция используется для качественного обнаружения фенола.

Фенол также даёт фиолетовое окрашивание с водным раствором хлорида железа (III), при этом образуется комплексная соль железа. Эту реакцию используют для качественного обнаружения фенола.

Фенол, как и бензол, реагирует с азотной кислотой. Но у фенола эта реакция идёт легче. В реакции фенола с азотной кислотой образуется 2, 4, 6-тринитрофенол, или пикриновая кислота.

Пикриновая кислота является сильной кислотой, так как наличие трёх заместителей в положении 2, 4, 6 усиливают её кислотные свойства. Пикриновая кислота является взрывоопасным веществом. Её соли используют в качестве взрывчатых веществ.
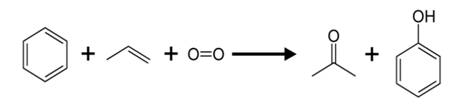
Одним из основных способов получения фенола в промышленности является кумольный метод. Для этого берут исходные вещества: бензол и пропен.
Сначала в реакцию вступает бензол с пропеном, образуется при этом изопропилбензол, или кумол. Затем кумол окисляют, продукт окисления кумола разлагается серной кислотой и получается фенол и ацетон.
Ранее фенол получали из каменноугольной смолы.
Фенол можно получить и из бензола: сначала хлорируют бензол, получают при этом хлорбензол, затем хлорбензол обрабатывают водным раствором щёлочи с образованием фенолятов. Затем на фенолят действуют минеральными кислотами и получают фенол.

Фенол находит широкое применение: на его основе синтезируют фенолформальдегидные смолы, фенол является сырьём для производства лаков и красок, пластмасс, клея, лекарственных препаратов (аспирина), красителей, пестицидов, антисептиков.
Гидрохинон – представитель класса фенолов – применяется в фотографии в качестве проявителя. Пирокатехин применяют для получения адреналина. Резорцин – антисептик при кожных заболеваниях, его используют в производстве красителей, стабилизаторов, пластификаторов.
Таким образом, фенол является простейшим представителем одноатомных фенолов. Химические свойства фенола обусловлены взаимным влиянием гидроксильной группы и бензольного кольца. Фенол проявляет большую активность в реакциях замещения и большую кислотность по сравнению со спиртами. Для фенола характерны реакции гидроксильной группы: со щелочными металлами, щелочами, а также реакции бензольного кольца: галогенирование и нитрирование. Фенол в основном получают кумольным методом. Фенол и его производные – основа синтеза многих ценных продуктов.

 Получите свидетельство
Получите свидетельство Вход
Вход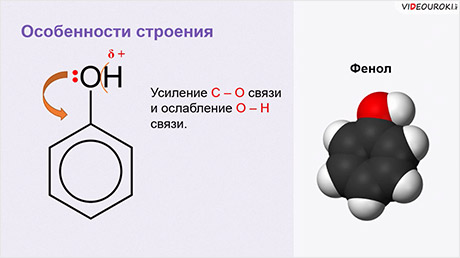



 0
0 10604
10604

